Elektrisk strøm i gasser
Ladningsbærere: elektroner, positive ioner, negative ioner.
Ladningsbærere oppstår i en gass som et resultat av ionisering: på grunn av bestråling av gassen, eller kollisjoner av partikler av en oppvarmet gass med hverandre.
Elektronstøt-ionisering.
A_ (felt) = eEl
e = 1,6 \ cdot 10 ^ (19) Cl;
E er retningen til feltet;
l er den gjennomsnittlige frie banen mellom to påfølgende kollisjoner av et elektron med gassatomer.
A_ (felt) = eEl \ geq W - ioniseringstilstand
W er ioniseringsenergien, dvs. energi som kreves for å rive et elektron ut av et atom

Antall elektroner øker eksponentielt, noe som resulterer i et elektronskred, og derav en utladning i gassen.
Elektrisk strøm i en væske
Væsker, akkurat som faste stoffer, kan være dielektriske stoffer, ledere og halvledere. Destillert vann er blant dielektrika, og løsninger av elektrolytter: syrer, alkalier, salter og metallsmelter er ledere. Flytende halvledere er smeltet selen og sulfidsmelter.
Elektrolytisk dissosiasjon
Når elektrolytter løses opp under påvirkning av det elektriske feltet til polare vannmolekyler, brytes elektrolyttmolekyler ned til ioner. For eksempel, CuSO_ (4) \ høyrepil Cu ^ (2 +) + SO ^ (2 -) _ (4).
Sammen med dissosiasjon pågår den motsatte prosessen - rekombinasjon , dvs. kombinere ioner med motsatte fortegn til nøytrale molekyler.
Bærerne av elektrisitet i elektrolyttløsninger er ioner. Denne ledningsevnen kalles ionisk .
Elektrolyse
Hvis elektroder plasseres i et bad med en elektrolyttløsning og en strøm påføres, vil negative ioner flytte til den positive elektroden, og positive ioner til den negative.
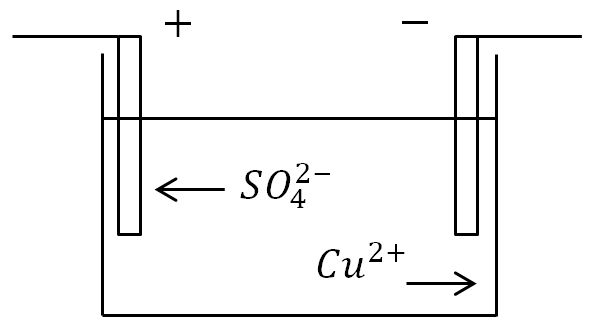
Ved anoden (positiv elektrode) donerer negativt ladede ioner overflødige elektroner (oksidativ reaksjon), og ved katoden (negativ elektrode) mottar positive ioner manglende elektroner (reduksjonsreaksjon).
Definisjon. Prosessen med frigjøring av stoffer på elektrodene forbundet med redoksreaksjoner kalles elektrolyse.
Faradays lover
JEG. Massen av stoffet som frigjøres ved elektroden er direkte proporsjonal med ladningen som strømmer gjennom elektrolytten:
m = kq
k er den elektrokjemiske ekvivalenten til stoffet.
q = I \ Delta t, da
m = kI \ Delta t
k = \ frac (1) (F) \ frac (\ mu) (n)
\ frac (\ mu) (n) - kjemisk ekvivalent av et stoff;
\ mu - molar masse;
n - valens
Elektrokjemiske ekvivalenter av stoffer er proporsjonale med kjemiske.
F er Faraday-konstanten;
Opprinnelsen til elektrisk strøm (bevegelse av elektriske ladninger) gjennom en løsning er vesentlig forskjellig fra bevegelsen av elektriske ladninger langs en metallleder.
Forskjellen er for det første at ladningsbærerne i løsninger ikke er elektroner, men ioner, dvs. selve atomene eller molekylene som har mistet eller fanget ett eller flere elektroner.
Naturligvis er denne bevegelsen, på en eller annen måte, ledsaget av en endring i egenskapene til selve stoffet.
Tenk på en elektrisk krets, hvis element er et kar med en løsning av natriumklorid og med elektroder av hvilken som helst form fra en plate satt inn i den. Når den er koblet til en strømkilde, vises en strøm i kretsen, som er bevegelsen av tunge ladede partikler - ioner i løsningen. Utseendet til ioner betyr allerede muligheten for kjemisk dekomponering av løsningen i to hovedelementer - Na og Cl. Natrium som har mistet et elektron er et positivt ladet ion som beveger seg mot en elektrode som er koblet til den negative polen til en strømkilde, en elektrisk krets. Klor, som "overtok" et elektron, er et negativt ion.
Negative klorioner beveger seg til elektroden, som er koblet til den positive polen til strømkilden. kjeder.
Dannelsen av positive og negative ioner skjer på grunn av den spontane nedbrytningen av saltmolekylet i en vandig løsning (elektrolytisk dissosiasjon). Bevegelsen av ioner er forårsaket av spenningen som påføres elektrodene dyppet i løsningen. Etter å ha nådd elektrodene, tar eller donerer ionene elektroner, og danner henholdsvis Cl- og Na-molekylene. Lignende fenomener observeres i løsninger av mange andre stoffer. Molekylene til disse stoffene, som molekylene til bordsalt, består av motsatt ladede ioner, som de brytes ned i oppløsninger. Antallet desintegrerte molekyler, mer presist antallet ioner, karakteriserer den elektriske motstanden til løsningen.
Vi understreker nok en gang at opprinnelsen til en elektrisk strøm langs en krets, hvis element er en løsning, forårsaker en bevegelse av substansen til dette elementet i en elektrisk krets, og derfor en endring i dens kjemiske egenskaper, mens under passering av en elektrisk strøm gjennom en metallleder, ingen endringer i lederen skjer.
Hva bestemmer mengden stoff som frigjøres under elektrolyse på elektrodene? Faraday var den første som svarte på dette spørsmålet. Faraday viste eksperimentelt at massen til det frigjorte stoffet er relatert til styrken til strømmen og tiden for dens strømning t ved forholdet (Faradays lov):
Massen av det frigjorte stoffet under elektrolysen av et stoff er direkte proporsjonalt med mengden elektrisitet som passerer gjennom elektrolytten og avhenger ikke av andre årsaker, bortsett fra typen stoff.
Dette mønsteret kan verifiseres i følgende eksperimenter. Hell den samme elektrolytten i flere bad, men med forskjellige konsentrasjoner. La oss sette elektroder av forskjellige områder inn i badekarene, og plassere dem i badekarene på forskjellige avstander. Vi kobler alle badene i serie og lar strømmen flyte gjennom dem. Da vil åpenbart samme mengde strøm passere gjennom hvert av badene. Etter å ha veid katodene før og etter forsøket, finner vi at like mye stoff ble frigjort på alle katodene. Ved å koble alle badene parallelt og føre en strøm gjennom dem, kan du sørge for at mengden stoff som frigjøres ved katodene er direkte proporsjonal med mengden elektrisitet som passerte gjennom hvert av dem. Til slutt, ved å koble sekvensielt bad med forskjellige elektrolytter, er det lett å fastslå at mengden av det frigjorte stoffet avhenger av typen av dette stoffet.
Verdien som karakteriserer avhengigheten av mengden av et stoff som frigjøres under elektrolyse av sitt slag kalles den elektrokjemiske ekvivalenten og er betegnet med bokstaven k.
Massen av stoffet som frigjøres under elektrolyse er den totale massen av alle ioner som slippes ut ved elektroden. Ved å utsette forskjellige salter for elektrolyse kan man eksperimentelt fastslå hvor mye elektrisitet som må passere gjennom elektrolytten for å frigjøre ett kilo – tilsvarende et gitt stoff. Slike eksperimenter ble først utført av Faraday. Han fant at frigjøring av ett kilo - tilsvarende et hvilket som helst stoff under elektrolyse krever samme mengde elektrisitet, lik 9,65 107 K.
Mengden elektrisitet som kreves for å frigjøre et kilogram av et stoffekvivalent under elektrolyse kalles Faraday-nummeret og er betegnet med bokstaven F:
F = 9,65 107 k.
I en elektrolytt er et ion omgitt av løsemiddelmolekyler (vann) med betydelige dipolmomenter. I samspill med et ion, vender dipolmolekyler mot det med endene, som har en ladning motsatt ladningen til ionet; derfor hemmes den ordnede bevegelsen av ionet i et elektrisk felt, og mobiliteten til ionene er betydelig dårligere til mobiliteten til ledningselektroner i metallet. Siden konsentrasjonen av ioner vanligvis ikke er høy sammenlignet med konsentrasjonen av elektroner i et metall, er den elektriske ledningsevnen til elektrolytter alltid betydelig mindre enn den elektriske ledningsevnen til metaller.
På grunn av sterk oppvarming av strøm i elektrolytter er det kun ubetydelige strømtettheter som kan oppnås, dvs. lav elektrisk feltstyrke. Med en økning i elektrolytttemperaturen forverres den ordnede orienteringen av løsningsmiddeldipolene under påvirkning av den økte tilfeldige bevegelsen av molekyler, derfor blir dipolskallet delvis ødelagt, mobiliteten til ioner og ledningsevnen til løsningen øker. Avhengigheten av spesifikk elektrisk ledningsevne av konsentrasjon ved konstant temperatur er kompleks. Hvis oppløsning er mulig i alle proporsjoner, har den elektriske ledningsevnen et maksimum ved en viss konsentrasjon. Årsaken til dette er denne: sannsynligheten for nedbrytning av molekyler til ioner er proporsjonal med antall løsemiddelmolekyler og antall molekyler av det løselige stoffet per volumenhet. Men den motsatte prosessen er også mulig: (rekombinasjon av ioner til molekyler), hvis sannsynlighet er proporsjonal med kvadratet av antall ionepar. Til slutt er elektrisk ledningsevne proporsjonal med antall ionepar per volumenhet. Derfor, ved lave konsentrasjoner, er dissosiasjonen fullstendig, men det totale antallet ioner er lite. Ved svært høye konsentrasjoner er dissosiasjonen svak og antallet ioner er også lite. Hvis løseligheten til et stoff er begrenset, observeres vanligvis ikke den maksimale elektriske ledningsevnen. Ved frysing øker viskositeten til en vandig løsning kraftig, mobiliteten til ioner reduseres kraftig, og den spesifikke elektriske ledningsevnen faller tusen ganger. Når flytende metaller størkner, endres nesten ikke elektronmobiliteten og den elektriske ledningsevnen.
Elektrolyse er mye brukt i ulike elektrokjemiske industrier. Den viktigste av dem: elektrolytisk produksjon av metaller fra vandige løsninger av deres salter og fra deres smeltede salter; elektrolyse av kloridsalter; elektrolytisk oksidasjon og reduksjon; oppnå hydrogen ved elektrolyse; galvanisering; elektrotype; elektropolering. Ved raffinering oppnås rent metall, renset fra urenheter. Galvanisering - dekker metallgjenstander med et annet lag av metall. Galvanisering - skaffe metallkopier fra relieffbilder av alle overflater. Elektropolering - utjevning av metalloverflater.
« Fysikk - klasse 10"
Hva er bærerne av elektrisk strøm i et vakuum?
Hva er arten av deres bevegelse?
Væsker, som faste stoffer, kan være dielektriske stoffer, ledere og halvledere. Dielektriske stoffer inkluderer destillert vann, ledere - løsninger og smelter av elektrolytter: syrer, alkalier og salter. Flytende halvledere er smeltet selen, sulfidsmelter, etc.
Elektrolytisk dissosiasjon.
Når elektrolytter løses opp under påvirkning av det elektriske feltet til polare vannmolekyler, brytes elektrolyttmolekyler ned til ioner.
Desintegreringen av molekyler til ioner under påvirkning av det elektriske feltet til polare vannmolekyler kalles elektrolytisk dissosiasjon.
Dissosiasjonsgrad- andelen i det oppløste stoffet av molekyler som har forfalt til ioner.
Graden av dissosiasjon avhenger av temperaturen, konsentrasjonen av løsningen og de elektriske egenskapene til løsningsmidlet.
Med økende temperatur øker graden av dissosiasjon, og følgelig øker konsentrasjonen av positivt og negativt ladede ioner.
Ioner med forskjellige tegn, når de møtes, kan igjen kombineres til nøytrale molekyler.
Under uendrede forhold etableres en dynamisk likevekt i løsningen, hvor antall molekyler som forfaller til ioner per sekund er lik antall ionpar, som igjen kombineres til nøytrale molekyler i løpet av samme tid.
Ioneledningsevne.
Ladningsbærere i vandige løsninger eller smeltede elektrolytter er positivt og negativt ladede ioner.
Hvis et kar med en elektrolyttløsning er inkludert i en elektrisk krets, vil negative ioner begynne å bevege seg til den positive elektroden - anoden, og positive ioner - til den negative - til katoden. Som et resultat vil en elektrisk strøm flyte gjennom kretsen.
Ledningsevnen til vandige løsninger eller elektrolyttsmelter, som utføres av ioner, kalles ionisk ledning.
Elektrolyse. Med ionisk ledning er strømmen assosiert med overføring av materie. På elektrodene skjer frigjøring av stoffer som utgjør elektrolyttene. Ved anoden gir negativt ladede ioner fra seg sine ekstra elektroner (i kjemi kalles dette en oksidativ reaksjon), og ved katoden mottar positive ioner de manglende elektronene (reduksjonsreaksjon).
Væsker kan også være elektronisk ledende. Flytende metaller har for eksempel slik ledningsevne.
Prosessen med frigjøring ved elektroden av et stoff assosiert med redoksreaksjoner kalles elektrolyse.
Hva bestemmer massen til et stoff som frigjøres over en viss tid? Det er klart at massen m til det frigjorte stoffet er lik produktet av massen m 0i til ett ion med antallet N i ioner som nådde elektroden i løpet av tiden Δt:
m = m 0i N i. (16.3)
Massen til ionet m 0i er lik:
hvor M er den molare (eller atomære) massen til stoffet, og N A er Avogadros konstant, det vil si antall ioner i en mol.
Antall ioner som når elektroden er
hvor Δq = IΔt er ladningen som har gått gjennom elektrolytten i løpet av tiden Δt; q 0i er ladningen til ionet, som bestemmes av valensen n til atomet: q 0i = ne (e er den elementære ladningen). Under dissosiasjonen av molekyler, for eksempel KBr, bestående av monovalente atomer (n = 1), oppstår ionene K + og Br -. Dissosiasjon av kobbersulfatmolekyler fører til utseendet av dobbeltladede ioner Cu 2+ og SO 2-4 (n = 2). Ved å erstatte uttrykk (16.4) og (16.5) i formel (16.3) og ta i betraktning at Δq = IΔt, a q 0i = ne, får vi
Faradays lov.
La oss betegne proporsjonalitetskoeffisienten mellom massen m av stoffet med k og ladningen Δq = IΔt som går gjennom elektrolytten:
hvor F = eN A = 9,65 10 4 C / mol - Faraday konstant.
Koeffisienten k avhenger av stoffets natur (verdier av M og n). I følge formel (16.6) har vi
m = kIΔt. (16,8)
Faradays lov om elektrolyse:
Massen av stoffet som frigjøres ved elektroden i løpet av tiden Δt. med passering av en elektrisk strøm er den proporsjonal med styrken til strømmen og tiden.
Denne uttalelsen, oppnådd teoretisk, ble først etablert eksperimentelt av Faraday.
Mengden k i formel (16.8) kalles elektrokjemisk ekvivalent av dette stoffet og er uttrykt i kilo per anheng(kg/Cl).
Fra formelen (16.8) kan man se at koeffisienten k er numerisk lik massen av stoffet som frigjøres på elektrodene under overføring av en ladning lik 1 C av ioner.

Den elektrokjemiske ekvivalenten har en enkel fysisk betydning. Siden M / N A = m 0i og en = q 0i, så ifølge formel (16.7) k = rn 0i / q 0i, det vil si at k er forholdet mellom massen til ion og ladningen.
Ved å måle verdiene til m og Δq er det mulig å bestemme de elektrokjemiske ekvivalentene til forskjellige stoffer.
Du kan bli overbevist om gyldigheten av Faradays lov av erfaring. La oss sette sammen installasjonen vist i figur (16.25). Alle tre elektrolysebadene er fylt med samme elektrolyttløsning, men strømmene som går gjennom dem er forskjellige. La oss betegne styrken til strømmene gjennom I1, I2, I3. Da er I 1 = I 2 + I 3. Ved å måle massene m 1, m 2, m 3 av stoffer som frigjøres på elektrodene i forskjellige bad, kan man forsikre seg om at de er proporsjonale med de tilsvarende styrkene til strømmene I 1, I 2, I 3.
Bestemmelse av elektronladningen.
Formel (16.6) for massen av stoffet som frigjøres på elektroden kan brukes for å bestemme elektronladningen. Fra denne formelen følger det at modulen til elektronladningen er lik:
Når vi kjenner massen m til det frigjorte stoffet under passering av ladningen IΔt, molmassen M, valensen til n atomer og Avogadros konstant N A, kan vi finne verdien av modulen til elektronladningen. Det viser seg å være lik e = 1,6 10 -19 C.
Det var på denne måten verdien av den elementære elektriske ladningen ble oppnådd for første gang i 1874.
Elektrolyseapplikasjon. Elektrolyse er mye brukt i teknologi til ulike formål. Dekk overflaten til ett metall elektrolytisk med et tynt lag av et annet ( nikkelbelegg, forkromning, gullbelegg etc.). Dette slitesterke belegget beskytter overflaten mot korrosjon. Hvis du sikrer god peeling av det elektrolytiske belegget fra overflaten som metallet er avsatt på (dette oppnås for eksempel ved å påføre grafitt på overflaten), så kan du få en kopi fra den pregede overflaten.
Prosessen med å skaffe avtrekkbare belegg - elektrotype- ble utviklet av den russiske vitenskapsmannen B.S. Jacobi (1801-1874), som i 1836 brukte denne metoden for å lage hule figurer til St. Isaks katedral i St. Petersburg.
Tidligere, i trykkeriindustrien, ble kopier fra en relieffflate (stereotyper) hentet fra matriser (et avtrykk av et sett på et plastmateriale), for hvilke et tykt lag med jern eller et annet stoff ble avsatt på matrisen. Dette gjorde det mulig å reprodusere settet i ønsket antall eksemplarer.
Ved hjelp av elektrolyse renses metaller fra urenheter. Således støpes råkobber fra malmen i form av tykke plater, som deretter legges i et bad som anoder. Under elektrolyse oppløses kobberet i anoden, urenheter som inneholder verdifulle og sjeldne metaller faller til bunnen, og rent kobber legger seg på katoden.
Ved hjelp av elektrolyse oppnås aluminium fra bauxittsmelte. Det var denne metoden for å produsere aluminium som gjorde den billig og sammen med jern den mest utbredte innen teknologi og hverdagsliv.
Ved hjelp av elektrolyse oppnås elektroniske tavler, som tjener som grunnlag for alle elektroniske produkter. En tynn kobberplate er limt på dielektrikumet, hvorpå et komplekst mønster av forbindelsesledninger er påført med en spesiell maling. Deretter legges platen i en elektrolytt, hvor områder av kobberlaget som ikke er dekket med maling, blir etset ut. Etter det vaskes malingen av, og detaljene til mikrokretsen vises på brettet.
Væsker, som faste stoffer, kan være ledere, halvledere og dielektriske stoffer. Denne leksjonen fokuserer på ledende væsker. Og ikke om væsker med elektronisk ledningsevne (smeltede metaller), men om væske-ledere av den andre typen (løsninger og smelter av salter, syrer, baser). Konduktivitetstypen til slike ledere er ionisk.
Definisjon... Ledere av den andre typen er slike ledere der kjemiske prosesser oppstår når strømmen flyter.
For en bedre forståelse av prosessen med strømledning i væsker, kan man tenke seg følgende eksperiment: To elektroder ble plassert i et vannbad, koblet til en strømkilde; i kretsen kan man ta en lyspære som strømindikator . Hvis du lukker en slik krets, vil ikke lampen brenne, noe som betyr at det ikke er strøm, noe som betyr at det er et brudd i kretsen, og vannet i seg selv leder ikke strøm. Men hvis du legger en viss mengde bordsalt på badet og gjentar stengingen, vil lyset tennes. Dette betyr at frie ladningsbærere, i dette tilfellet ioner, begynte å bevege seg i badekaret mellom katoden og anoden (fig. 1).

Ris. 1. Opplegg for forsøket
Elektrolyttledningsevne
Hvor kommer gratisutgifter fra i det andre tilfellet? Som nevnt i en av de foregående leksjonene, er noen dielektriske stoffer polare. Vann har akkurat de samme polare molekylene (fig. 2).

Ris. 2. Polariteten til vannmolekylet
Når salt tilsettes vann, er vannmolekyler orientert på en slik måte at deres negative poler er nær natrium, og positive er nær klor. Som et resultat av interaksjoner mellom ladninger, bryter vannmolekyler saltmolekyler i par med ulikt ioner. Natriumionet har positiv ladning, klorionet er negativt (fig. 3). Det er disse ionene som vil bevege seg mellom elektrodene under påvirkning av et elektrisk felt.

Ris. 3. Skjema for dannelsen av frie ioner
Når natriumioner nærmer seg katoden, mottar den sine manglende elektroner, mens klorioner, når de når anoden, gir opp sine.
Elektrolyse
Siden strømmen av strøm i væsker er assosiert med overføring av materie, foregår elektrolyseprosessen med en slik strøm.
Definisjon. Elektrolyse er en prosess forbundet med redoksreaksjoner, der et stoff frigjøres på elektrodene.
Stoffer som som følge av slike spaltninger gir ionisk ledningsevne kalles elektrolytter. Dette navnet ble foreslått av den engelske fysikeren Michael Faraday (fig. 4).
Elektrolyse gjør det mulig å få stoffer fra løsninger i en tilstrekkelig ren form, derfor brukes den til å oppnå sjeldne materialer som natrium, kalsium ... i ren form. Dette gjøres ved den såkalte elektrolytiske metallurgien.
Faradays lover
I sitt første arbeid om elektrolyse i 1833 presenterte Faraday sine to lover for elektrolyse. Den første handlet om massen av stoffet som ble frigjort på elektrodene:
Faradays første lov sier at denne massen er proporsjonal med ladningen som går gjennom elektrolytten:
Her spilles rollen til proporsjonalitetskoeffisienten av mengden - den elektrokjemiske ekvivalenten. Dette er en tabellverdi som er unik for hver elektrolytt og er dens hovedkarakteristikk. Dimensjon på den elektrokjemiske ekvivalenten:
![]()
Den fysiske betydningen av den elektrokjemiske ekvivalenten er massen som frigjøres på elektroden når mengden elektrisitet i 1 C passerer gjennom elektrolytten.
Hvis du husker formlene fra emnet om likestrøm:
Da kan du representere den første Faradays lov i formen:
Faradays andre lov angår direkte måling av den elektrokjemiske ekvivalenten gjennom andre konstanter for en gitt elektrolytt:
Her: - molar masse av elektrolytten; - elementær ladning; - valens av elektrolytten; er Avogadros nummer.
Mengden kalles den kjemiske ekvivalenten til elektrolytten. Det vil si at for å kjenne den elektrokjemiske ekvivalenten er det nok å kjenne den kjemiske ekvivalenten, resten av formlene er verdenskonstanter.
Basert på den andre Faradays lov, kan den første loven representeres som:
![]()
Faraday foreslo en terminologi for disse ionene når det gjelder elektroden de beveger seg til. Positive ioner kalles kationer fordi de beveger seg mot den negativt ladede katoden, negative ladninger kalles anioner når de beveger seg mot anoden.
Den ovenfor beskrevne handlingen til vann for å bryte et molekyl i to ioner kalles elektrolytisk dissosiasjon.
I tillegg til løsninger kan smelter også være ledere av den andre typen. I dette tilfellet oppnås tilstedeværelsen av frie ioner ved at ved høye temperaturer begynner svært aktive molekylære bevegelser og vibrasjoner, som et resultat av at ødeleggelsen av molekyler til ioner oppstår.
Praktisk anvendelse av elektrolyse
Den første praktiske anvendelsen av elektrolyse skjedde i 1838 av den russiske forskeren Jacobi. Ved hjelp av elektrolyse fikk han et avtrykk av figurer for St. Isak-katedralen. Denne anvendelsen av elektrolyse kalles elektroforming. Et annet bruksområde er galvanisering - belegg av ett metall med et annet (krombelegg, nikkelbelegg, gullbelegg, etc., Fig. 5)
- Fatyf.narod.ru ().
- Kjemi ().
- Ens.tpu.ru ().
Hjemmelekser
- Hva er elektrolytter?
- Hva er de to fundamentalt forskjellige typene væsker som en elektrisk strøm kan flyte i?
- Hva er mekanismene for dannelsen av gratis ladningsbærere?
- * Hvorfor er massen som frigjøres på elektroden proporsjonal med ladningen?





