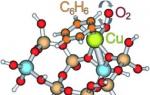
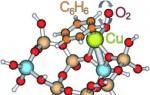
Ratene av kjemiske reaksjoner kan øke dramatisk i nærvær av forskjellige stoffer som ikke er reaktanter og ikke er en del av reaksjonsproduktene. Dette bemerkelsesverdige fenomenet kalles katalyse(fra det greske "katalyse" - ødeleggelse). Et stoff som øker hastigheten på en reaksjon i en blanding kalles katalysator. Mengden før og etter reaksjonen forblir uendret. Katalysatorer representerer ingen spesiell klasse av stoffer. I ulike reaksjoner kan metaller, oksider, syrer, salter og komplekse forbindelser utvise en katalytisk effekt. Kjemiske reaksjoner i levende celler fortsetter under kontroll av katalytiske proteiner kalt enzymer. Katalyse bør betraktes som en sann kjemisk faktor for å øke hastigheten på kjemiske reaksjoner, siden katalysatoren er direkte involvert i reaksjonen. Katalyse er ofte kraftigere og mindre risikabelt for å fremskynde en reaksjon enn å øke temperaturen. Dette er tydelig manifestert i eksemplet med kjemiske reaksjoner i levende organismer. Reaksjoner, som hydrolyse av proteiner, som i laboratorier må utføres med langvarig oppvarming til kokepunktet, under fordøyelsen fortsetter uten oppvarming til kroppstemperatur.
For første gang ble fenomenet katalyse observert av den franske kjemikeren L. J. Tenard (1777-1857) i 1818. Han oppdaget at oksider av visse metaller, når hydrogenperoksid tilsettes en løsning, forårsaker dens nedbrytning. En slik opplevelse er lett å reprodusere ved å tilsette krystaller av kaliumpermanganat til en 3% hydrogenperoksidløsning. Salt KMp0 4 blir til Mn0 2, og oksygen frigjøres raskt fra løsningen under påvirkning av oksid:
Den direkte effekten av katalysatoren på reaksjonshastigheten er assosiert med en reduksjon i aktiveringsenergien. Ved normal temperaturnedgang? og med 20 kJ/mol øker hastighetskonstanten med omtrent 3000 ganger. nedgradere E L kan være mye sterkere. Imidlertid er reduksjonen i aktiveringsenergien en ytre manifestasjon av katalysatorens virkning. Reaksjonen er preget av en viss verdi E. v som bare kan endres hvis selve reaksjonen endres. Ved å gi de samme produktene, fortsetter reaksjonen med deltagelse av det tilsatte stoffet langs en annen vei, gjennom forskjellige stadier og med en annen aktiveringsenergi. Hvis aktiveringsenergien på denne nye banen er lavere og reaksjonen er tilsvarende raskere, så sier vi at dette stoffet er en katalysator.
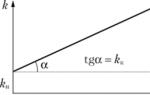
Katalysatoren interagerer med en av reaktantene, og danner en mellomliggende forbindelse. På et av de påfølgende stadiene av reaksjonen regenereres katalysatoren - den forlater reaksjonen i sin opprinnelige form. Reagenser, som deltar i en katalytisk reaksjon, fortsetter å samhandle med hverandre og langs en langsom bane uten deltakelse av en katalysator. Derfor tilhører katalytiske reaksjoner en rekke komplekse reaksjoner kalt serieparallelle. På fig. 11.8 viser hastighetskonstantens avhengighet av konsentrasjonen av katalysatoren. Avhengighetsgrafen går ikke gjennom null, siden reaksjonen ikke stopper i fravær av en katalysator.

Ris. 11.8.
observerbar konstant k uttrykt som en sum k u+ & k c(k)
Eksempel 11.5. Ved en temperatur på -500 °C, oksidasjonsreaksjonen av svoveloksid (IV)
som er et av stadiene i industriell produksjon av svovelsyre, er veldig sakte. En ytterligere temperaturøkning er uakseptabel, siden likevekten skifter til venstre (eksoterm reaksjon) og produktutbyttet faller for mye. Men denne reaksjonen akselereres av forskjellige katalysatorer, hvorav en kan være nitrogenoksid (II). Først reagerer katalysatoren med oksygen: ![]()
og overfører deretter et oksygenatom til svoveloksid (IV):
Dermed dannes sluttproduktet av reaksjonen og katalysatoren regenereres. For reaksjonen ble muligheten for å strømme langs en ny bane åpnet, der hastighetskonstantene økte betydelig:

Diagrammet nedenfor viser begge veiene til S0 2 oksidasjonsprosessen. I fravær av en katalysator, fortsetter reaksjonen bare langs den langsomme banen, og i nærvær av en katalysator, langs begge.
Det er to typer katalyse - homogen og heterogen. I det første tilfellet danner katalysatoren og reagensene et homogent system i form av en gassblanding eller løsning. Et eksempel på svoveloksidoksidasjon er homogen katalyse. Hastigheten til en homogen katalytisk reaksjon avhenger av både konsentrasjonene av reaktantene og konsentrasjonen av katalysatoren.
I heterogen katalyse er katalysatoren et fast stoff i ren form eller båret på transportør. For eksempel kan platina som katalysator festes på asbest, alumina, etc. Reagensmolekyler adsorberes (absorberes) fra en gass eller løsning på bestemte punkter på katalysatoroverflaten - aktive sentre og aktiveres samtidig. Etter den kjemiske transformasjonen desorberes de resulterende produktmolekylene fra katalysatoroverflaten. Handlinger av partikkeltransformasjon gjentas ved aktive sentre. Blant andre faktorer avhenger hastigheten på en heterogen katalytisk reaksjon av overflatearealet til det katalytiske materialet.
Heterogen katalyse er spesielt mye brukt i industrien. Dette skyldes at det er enkelt å utføre en kontinuerlig katalytisk prosess med passasje av en blanding av reagenser gjennom et kontaktapparat med en katalysator.
Katalysatorer virker selektivt, og akselererer en veldig spesifikk type reaksjon eller til og med en enkelt reaksjon uten å påvirke andre. Dette gjør det mulig å bruke katalysatorer ikke bare for å fremskynde reaksjoner, men også for målrettet å omdanne utgangsmaterialer til ønskede produkter. Metan og vann ved 450 ° C på Fe 2 0 3-katalysatoren omdannes til karbondioksid og hydrogen:
De samme stoffene ved 850 °C reagerer på nikkeloverflaten og danner karbonmonoksid (II) og hydrogen:

Katalyse tilhører de kjemiområdene der det ennå ikke er mulig å lage nøyaktige teoretiske spådommer. Alle industrielle katalysatorer for prosessering av petroleumsprodukter, naturgass, ammoniakkproduksjon og mange andre er utviklet på grunnlag av møysommelige og lange eksperimentelle studier.
Evnen til å kontrollere hastigheten til kjemiske prosesser er av uvurderlig betydning i menneskelig økonomisk aktivitet. I industriell produksjon av kjemiske produkter er det vanligvis nødvendig å øke hastigheten på teknologiske kjemiske prosesser, og ved lagring av produkter er det nødvendig å redusere nedbrytningshastigheten eller eksponeringen for oksygen, vann, etc. Kjente stoffer som kan bremse kjemiske reaksjoner. De heter inhibitorer, eller negative katalysatorer. Inhibitorer skiller seg fundamentalt fra ekte katalysatorer ved at de reagerer med aktive stoffer (frie radikaler) som av en eller annen grunn oppstår i et stoff eller dets miljø og forårsaker verdifulle nedbrytnings- og oksidasjonsreaksjoner. Hemmere blir gradvis konsumert, og avslutter deres beskyttende virkning. Den viktigste typen hemmere er antioksidanter, som beskytter ulike materialer mot effekten av oksygen.
Det bør også minnes om hva som ikke kan oppnås ved hjelp av katalysatorer. De er kun i stand til å akselerere spontane reaksjoner. Hvis reaksjonen ikke fortsetter spontant, vil ikke katalysatoren være i stand til å akselerere den. For eksempel kan ingen katalysator få vann til å brytes ned til hydrogen og oksygen. Denne prosessen kan bare utføres ved elektrolyse, mens du bruker elektrisk arbeid.
Katalysatorer kan også aktivere uønskede prosesser. De siste tiårene har det skjedd en gradvis ødeleggelse av ozonlaget i atmosfæren i en høyde på 20-25 km. Det antas at noen stoffer er involvert i nedbrytningen av ozon, for eksempel halogenerte hydrokarboner som slippes ut i atmosfæren av industribedrifter, samt brukes til husholdningsformål.
Catamlis- selektiv akselerasjon av en av de mulige termodynamisk tillatte retningene for en kjemisk reaksjon under påvirkning av en katalysator(er), som gjentatte ganger går inn i en mellomliggende kjemisk interaksjon med reaksjonsdeltakerne og gjenoppretter dens kjemiske sammensetning etter hver syklus av mellomliggende kjemiske interaksjoner. Begrepet "katalyse" ble introdusert i 1835 av den svenske vitenskapsmannen Jöns Jakob Berzelius.
Fenomenet katalyse er utbredt i naturen (de fleste prosessene som forekommer i levende organismer er katalytiske) og er mye brukt i teknologi (i oljeraffinering og petrokjemi, i produksjon av svovelsyre, ammoniakk, salpetersyre, etc.). De fleste av alle industrielle reaksjoner er katalytiske.
Katalysatorer Stoffer som endrer hastigheten på kjemiske reaksjoner kalles.
Noen katalysatorer akselererer reaksjonen kraftig - positiv katalyse, eller bare katalyse, andre bremser ned - negativ katalyse. Eksempler på positiv katalyse er produksjon av svovelsyre, oksidasjon av ammoniakk til salpetersyre ved bruk av en platinakatalysator, etc.
I henhold til påvirkningen på reaksjonshastigheten deles katalyse inn i positiv (reaksjonshastigheten øker) og negativ (reaksjonshastigheten avtar). I sistnevnte tilfelle finner en inhiberingsprosess sted, som ikke kan betraktes som "negativ katalyse", siden inhibitoren forbrukes under reaksjonen.
Katalyse kan være homogen og heterogen (kontakt). Ved homogen katalyse er katalysatoren i samme fase som reaktantene, mens heterogene katalysatorer er forskjellige i fase.
homogen katalyse.
Et eksempel homogen katalyse er dekomponering av hydrogenperoksid i nærvær av jodioner. Reaksjonen foregår i to trinn:
H2 O2+I> H2O+IO, H2O2+io> H2O + O2+ jeg
Ved homogen katalyse skyldes virkningen av katalysatoren det faktum at den interagerer med reaktantene for å danne mellomliggende forbindelser, noe som fører til en reduksjon i aktiveringsenergien.
heterogen katalyse.
I heterogen katalyse skjer akselerasjonen av prosessen vanligvis på overflaten av et fast legeme - katalysatoren, så aktiviteten til katalysatoren avhenger av størrelsen og egenskapene til overflaten. I praksis er katalysatoren vanligvis båret på en fast porøs bærer.
Mekanismen for heterogen katalyse er mer komplisert enn den for homogen katalyse. Mekanismen for heterogen katalyse inkluderer fem stadier, som alle er reversible.
- 1. Diffusjon av reaktanter til overflaten av et fast stoff
- 2. Fysisk adsorpsjon på de aktive stedene på overflaten av et fast stoff av reagerende molekyler og deretter deres kjemisorpsjon
- 3. Kjemisk reaksjon mellom reagerende molekyler
- 4. Desorpsjon av produkter fra katalysatoroverflaten
- 5. Diffusjon av produktet fra katalysatoroverflaten til den generelle strømmen
Et eksempel på heterogen katalyse er oksidasjon av SO 2 til SO 3 på en V 2 O 5 katalysator ved produksjon av svovelsyre (kontaktmetode).
De fleste katalytiske reaksjoner utføres på porøse katalysatorer, hvis indre overflate består av porer og kanaler av forskjellige størrelser og lengder. Disse porene kan være isolert eller forbundet med hverandre. Hovedfaktoren som bestemmer hastigheten og arten av bevegelsen av gasser i porene til katalysatoren er porestørrelsen. Hastigheten på den frie bevegelsen av molekyler kan nå 1000 m/s, og retardasjonen av bevegelsen i porene er assosiert med kollisjoner mellom gassmolekyler og med veggene i porene.
De fleste katalytiske reaksjoner er ikke-selektive, noe som pålegger kjente begrensninger på kinetiske analysemetoder.
De fleste katalytiske reaksjoner involverer flere forskjellige typer atomer og molekyler. Å bestemme reaksjonsmekanismen og arten av kreftene som virker mellom disse atomene og molekylene og mellom dem og overflaten er selvfølgelig en vanskelig oppgave, men den kan forenkles ved å studere adsorpsjonsadferden til en type atomer eller molekyler . Slike studier har vist at når visse molekyler adsorberes på visse adsorbenter, brytes bindingen i molekylet og to bindinger med adsorbenten oppstår; i dette tilfellet forvandles det adsorberte molekylet til to adsorberte atomer. Denne prosessen er en overflatekjemisk reaksjon, og de dannede adsorberte atomene kalles kjemisorberte atomer. Hvis en slik reaksjon ikke skjer ved tilstrekkelig lave temperaturer og de adsorberte molekylene ikke brytes ned til to adsorberte atomer, kalles slike molekyler fysisk adsorbert.
akselerasjon av kjemiske reaksjoner under påvirkning av små mengder stoffer (katalysatorer), som i seg selv ikke endres under reaksjonen. Katalytiske prosesser spiller en stor rolle i livet vårt. Biologiske katalysatorer kalt enzymer er involvert i reguleringen av biokjemiske prosesser. Mange industrielle prosesser ville ikke vært mulig uten katalysatorer.Den viktigste egenskapen til katalysatorer er selektivitet, dvs. evnen til å øke hastigheten på bare visse kjemiske reaksjoner av mange mulige. Dette gjør at reaksjoner som er for langsomme under normale forhold kan være av praktisk nytte, og sikrer dannelsen av de ønskede produktene.
Bruken av katalysatorer bidro til den raske utviklingen av den kjemiske industrien. De er mye brukt i oljeraffinering, skaffe ulike produkter, skape nye materialer (for eksempel plast), ofte billigere enn de som ble brukt før. Omtrent 90 % av moderne kjemisk produksjon er basert på katalytiske prosesser. Katalytiske prosesser spiller en spesiell rolle i miljøvern.
I 1835 fant den svenske kjemikeren J. Berzelius at i nærvær av visse stoffer øker hastigheten på visse kjemiske reaksjoner betydelig. For slike stoffer introduserte han begrepet "katalysator" (fra gresk.
katalyse- avslapning). Ifølge Berzelius har katalysatorer en spesiell evne til å svekke bindingene mellom atomer i molekylene som er involvert i reaksjonen, og dermed lette deres interaksjon. Et stort bidrag til utviklingen av ideer om driften av katalysatorer ble gitt av den tyske fysiokjemikeren W. Ostwald, som i 1880 definerte en katalysator som et stoff som endrer reaksjonshastigheten.I følge moderne konsepter danner en katalysator et kompleks med reagerende molekyler, som stabiliseres av kjemiske bindinger. Etter omorganisering dissosieres dette komplekset for å frigjøre produkter og katalysator. For en monomolekylær reaksjon av transformasjonen av et molekyl
X til Y Hele prosessen kan representeres som X + Kat. ® X -Kat. ® Y -Kat. ® Y + Kat. Den frigjorte katalysatoren binder seg på nytt med X , og hele syklusen gjentas mange ganger, noe som gir dannelsen av store mengder av produktet - stoffet Y . Mange stoffer under normale forhold inngår ikke en kjemisk reaksjon med hverandre. Så hydrogen og karbonmonoksid ved romtemperatur interagerer ikke med hverandre, siden bindingen mellom atomer i et molekyl H2 sterk nok og brytes ikke når den blir angrepet av et molekyl CO . Katalysator bringer molekyler sammen H2 og CO ved å danne forbindelser med dem. Etter omorganisering dissosieres katalysator-reaktantkomplekset for å danne et produkt som inneholder atomer C, H og O. Ofte, når de samme stoffene interagerer, dannes det forskjellige produkter. Katalysatoren kan lede prosessen langs veien som er mest gunstig for dannelsen av et bestemt produkt. Vurder reaksjonen mellom CO og H2 . I nærvær av en kobberholdig katalysator er metanol praktisk talt det eneste reaksjonsproduktet:Først CO og H molekyler 2 adsorbert på katalysatoroverflaten. Deretter danner CO-molekylene kjemiske bindinger med katalysatoren (kjemisorpsjon oppstår), forblir i udissosiert form. Hydrogenmolekyler kjemisorberes også på katalysatoroverflaten, men dissosieres samtidig. Som et resultat av omorganiseringen ble overgangskomplekset H-Kat.- CH2OH . Etter å ha lagt til et atom H komplekset brytes ned for å frigjøres CH3OH og katalysator. I nærvær av en nikkelkatalysator, både CO og H 2 kjemisorberes på overflaten i dissosiert form, og Cat.-CH-komplekset dannes 3 . Sluttproduktene av reaksjonen er CH 4 og H20: De fleste katalytiske reaksjoner utføres ved visse trykk og temperaturer ved å føre reaksjonsblandingen, som er i gassform eller flytende tilstand, gjennom en reaktor fylt med katalysatorpartikler. Følgende begreper brukes for å beskrive reaksjonsbetingelsene og karakterisere produktene. Romhastighet - volumet av gass eller væske som passerer gjennom en enhetsvolum av katalysatoren per tidsenhet. Katalytisk aktivitet - mengden reaktanter omdannet av katalysatoren til produkter per tidsenhet. Konvertering er andelen av et stoff omdannet i en gitt reaksjon. Selektivitet er forholdet mellom mengden av et bestemt produkt og den totale mengden produkter (vanligvis uttrykt i prosent). Utbytte - forholdet mellom mengden av et gitt produkt og mengden utgangsmateriale (vanligvis uttrykt i prosent). Produktivitet - mengden reaksjonsprodukter som dannes per volumenhet per tidsenhet. TYPER KATALYSATER
Katalysatorer er klassifisert etter arten av reaksjonen de fremmer, deres kjemiske sammensetning eller deres fysiske egenskaper. Nesten alle kjemiske elementer og stoffer har katalytiske egenskaper i en eller annen grad - alene eller, oftere, i forskjellige kombinasjoner. I henhold til deres fysiske egenskaper er katalysatorer delt inn i homogene og heterogene. Heterogene katalysatorer er faste stoffer som er homogene og dispergert i samme gassformige eller flytende medium som reaktantene.
De fleste katalytiske reaksjoner utføres ved visse trykk og temperaturer ved å føre reaksjonsblandingen, som er i gassform eller flytende tilstand, gjennom en reaktor fylt med katalysatorpartikler. Følgende begreper brukes for å beskrive reaksjonsbetingelsene og karakterisere produktene. Romhastighet - volumet av gass eller væske som passerer gjennom en enhetsvolum av katalysatoren per tidsenhet. Katalytisk aktivitet - mengden reaktanter omdannet av katalysatoren til produkter per tidsenhet. Konvertering er andelen av et stoff omdannet i en gitt reaksjon. Selektivitet er forholdet mellom mengden av et bestemt produkt og den totale mengden produkter (vanligvis uttrykt i prosent). Utbytte - forholdet mellom mengden av et gitt produkt og mengden utgangsmateriale (vanligvis uttrykt i prosent). Produktivitet - mengden reaksjonsprodukter som dannes per volumenhet per tidsenhet. TYPER KATALYSATER
Katalysatorer er klassifisert etter arten av reaksjonen de fremmer, deres kjemiske sammensetning eller deres fysiske egenskaper. Nesten alle kjemiske elementer og stoffer har katalytiske egenskaper i en eller annen grad - alene eller, oftere, i forskjellige kombinasjoner. I henhold til deres fysiske egenskaper er katalysatorer delt inn i homogene og heterogene. Heterogene katalysatorer er faste stoffer som er homogene og dispergert i samme gassformige eller flytende medium som reaktantene. Mange heterogene katalysatorer inneholder metaller. Noen metaller, spesielt de som er relatert til
VIII gruppe av det periodiske systemet av elementer, har katalytisk aktivitet i seg selv; et typisk eksempel er platina. Men de fleste metaller viser katalytiske egenskaper, idet de er i sammensetningen av forbindelser; eksempel - alumina (aluminiumoksid Al203). En uvanlig egenskap til mange heterogene katalysatorer er deres store overflateareal. De penetreres av mange porer, hvis totale areal noen ganger når 500 m 2 per 1 g katalysator. I mange tilfeller tjener oksider med et stort overflateareal som et substrat hvor metallkatalysatorpartikler avsettes i form av små klynger. Dette sikrer effektiv interaksjon av reagensene i gass- eller væskefasen med det katalytisk aktive metallet. En spesiell klasse av heterogene katalysatorer er zeolitter - krystallinske mineraler fra gruppen av aluminosilikater (forbindelser av silisium og aluminium). Selv om mange heterogene katalysatorer har et stort overflateareal, har de vanligvis bare et lite antall aktive steder, som utgjør en liten del av det totale overflatearealet. Katalysatorer kan miste sin aktivitet i nærvær av små mengder kjemiske forbindelser kalt katalysatorgifter. Disse stoffene binder seg til aktive sentre og blokkerer dem. Å bestemme strukturen til aktive sentre er gjenstand for intens forskning.Homogene katalysatorer har forskjellig kjemisk natur - syrer (H
2 SO 4 eller H 3 RO 4 ), baser (NaOH ), organiske aminer, metaller, oftest overgangsbestemmelser ( Fe eller Rh ), i form av salter, organometalliske forbindelser eller karbonyler. Katalysatorer inkluderer også enzymer - proteinmolekyler som regulerer biokjemiske reaksjoner. Det aktive stedet til noen enzymer inneholder et metallatom ( Zn, Cu, Fe eller Mo). Metallholdige enzymer katalyserer reaksjoner som involverer små molekyler ( O 2 , CO 2 eller N 2 ). Enzymer har svært høy aktivitet og selektivitet, men de virker bare under visse forhold, for eksempel de der reaksjoner oppstår i levende organismer. Industrien bruker ofte den såkalte. immobiliserte enzymer. HVORDAN KATALYSATORER FUNGERER Energi. Enhver kjemisk reaksjon kan bare fortsette hvis reaktantene overvinner energibarrieren, og for dette må de tilegne seg en viss energi. Som vi allerede har sagt, den katalytiske reaksjonen X ® Y består av en rekke påfølgende stadier. Hver og en trenger energi for å løpe.E kalt aktiveringsenergien. Endringen i energi langs reaksjonskoordinaten er vist i fig. en.Tenk først på den ikke-katalytiske, "termiske" banen. For at en reaksjon skal finne sted, den potensielle energien til molekylene
X må overskride energibarrierenE T . Den katalytiske reaksjonen består av tre stadier. Den første er dannelsen av X-Cat-komplekset. (kjemisorpsjon), hvis aktiveringsenergi erE annonser . Det andre trinnet er X-Cat-omorganiseringen.® Y -Katt. med aktiveringsenergiE katt , og til slutt, den tredje - desorpsjon med aktiveringsenergiE des; E annonser, E kat og E er mye mindre E T . Siden reaksjonshastigheten avhenger eksponentielt av aktiveringsenergien, fortsetter den katalytiske reaksjonen mye raskere enn den termiske ved en gitt temperatur.En katalysator kan sammenlignes med en instruktør-guide som guider klatrere (reagerende molekyler) gjennom en fjellkjede. Han leder en gruppe gjennom passet og returnerer deretter til neste. Banen gjennom passet ligger mye lavere enn den som ligger gjennom toppen (reaksjonens termiske kanal), og gruppen gjør overgangen raskere enn uten en leder (katalysator). Det er til og med mulig at gruppen på egenhånd ikke hadde klart å overvinne ryggen i det hele tatt.
Teorier om katalyse. Tre grupper av teorier har blitt foreslått for å forklare mekanismen for katalytiske reaksjoner: geometriske, elektroniske og kjemiske. I geometriske teorier er hovedoppmerksomheten rettet mot samsvaret mellom den geometriske konfigurasjonen av atomene til de aktive sentrene til katalysatoren og atomene til den delen av de reagerende molekylene som er ansvarlig for binding til katalysatoren. Elektroniske teorier er basert på ideen om at kjemisorpsjon skyldes elektronisk interaksjon knyttet til ladningsoverføring, dvs. disse teoriene relaterer katalytisk aktivitet til de elektroniske egenskapene til katalysatoren. Kjemisk teori anser en katalysator som en kjemisk forbindelse med karakteristiske egenskaper som danner kjemiske bindinger med reaktanter, noe som resulterer i dannelsen av et ustabilt overgangskompleks. Etter dekomponering av komplekset med frigjøring av produkter, går katalysatoren tilbake til sin opprinnelige tilstand. Sistnevnte teori anses nå som den mest dekkende.På molekylært nivå kan en katalytisk gassfasereaksjon representeres som følger. Ett reagerende molekyl binder seg til det aktive stedet for katalysatoren, mens det andre interagerer med det mens det er direkte i gassfasen. En alternativ mekanisme er også mulig: de reagerende molekylene adsorberes på nærliggende aktive steder av katalysatoren og samhandler deretter med hverandre. Det er tilsynelatende slik de fleste katalytiske reaksjoner foregår.
Et annet konsept antyder at det er en sammenheng mellom det romlige arrangementet av atomer på katalysatoroverflaten og dens katalytiske aktivitet. Hastigheten til noen katalytiske prosesser, inkludert mange hydrogeneringsreaksjoner, avhenger ikke av det gjensidige arrangementet av katalytisk aktive atomer på overflaten; hastigheten til andre, tvert imot, endres betydelig med en endring i den romlige konfigurasjonen av overflateatomer. Et eksempel er isomerisering av neopentan til isopentan og samtidig krakking av sistnevnte til isobutan og metan på katalysatoroverflaten.
Pt-Al203. ANVENDELSE AV KATALYSE I INDUSTRIEN Den raske industrielle veksten som vi nå opplever, ville ikke vært mulig uten utviklingen av nye kjemiske teknologier. I stor grad bestemmes denne fremgangen av den utbredte bruken av katalysatorer, ved hjelp av hvilke lavverdige råvarer omdannes til høyverdige produkter. Figurativt sett er katalysatoren filosofens stein til den moderne alkymisten, bare den gjør ikke bly til gull, men råvarer til medisiner, plast, kjemiske reagenser, drivstoff, gjødsel og andre nyttige produkter.Kanskje den aller første katalytiske prosessen som mennesket lærte å bruke er gjæring. Oppskrifter for tilberedning av alkoholholdige drikker var kjent for sumererne så tidlig som 3500 f.Kr.
Cm. VIN; ØL.En betydelig milepæl i den praktiske anvendelsen av katalyse var produksjonen av margarin ved katalytisk hydrogenering av vegetabilsk olje. For første gang ble denne reaksjonen i industriell skala utført rundt 1900. Og fra 1920-tallet ble det, den ene etter den andre, utviklet katalytiske metoder for produksjon av nye organiske materialer, først og fremst plast. Nøkkelpunktet var den katalytiske produksjonen av olefiner, nitriler, estere, syrer, etc. - "byggeklosser" for kjemisk "bygging" av plast.
Den tredje bølgen av industriell bruk av katalytiske prosesser skjer på 1930-tallet og er assosiert med oljeraffinering. Når det gjelder volum, la denne produksjonen snart alle andre langt bak. Oljeraffinering består av flere katalytiske prosesser: krakking, reformering, hydrosulfonering, hydrokrakking, isomerisering, polymerisering og alkylering.
Og til slutt, den fjerde bølgen i bruken av katalyse er relatert til miljøvern. Den mest kjente prestasjonen på dette området er etableringen av en katalysator for bileksosgasser. Katalysatorer, som har vært installert i biler siden 1975, har spilt en stor rolle i å forbedre luftkvaliteten og har reddet mange liv på denne måten.
Omtrent et dusin nobelpriser har blitt delt ut for arbeid innen katalyse og relaterte felt.
Den praktiske betydningen av katalytiske prosesser fremgår av det faktum at andelen nitrogen, som er en del av de nitrogenholdige forbindelsene som oppnås industrielt, utgjør omtrent halvparten av alt nitrogen som inngår i matvarer. Mengden nitrogenforbindelser som produseres naturlig er begrenset, slik at produksjonen av kostprotein avhenger av mengden nitrogen som tilføres jorda med gjødsel. Det ville være umulig å mate selv halvparten av menneskeheten uten syntetisk ammoniakk, som nesten utelukkende produseres av Haber-Bosch-katalytisk prosess.
Omfanget av katalysatorer utvides stadig. Det er også viktig at katalyse kan øke effektiviteten til tidligere utviklede teknologier betydelig. Et eksempel er forbedringen i katalytisk cracking ved bruk av zeolitter.
Hydrogenering. Et stort antall katalytiske reaksjoner er assosiert med aktivering av et hydrogenatom og et annet molekyl, noe som fører til deres kjemiske interaksjon. Denne prosessen kalles hydrogenering og ligger til grunn for mange stadier av oljeraffinering og produksjon av flytende brensel fra kull (Bergius-prosessen).Produksjonen av flybensin og motordrivstoff fra kull ble utviklet i Tyskland under andre verdenskrig, siden det ikke er oljefelt i dette landet. Bergius-prosessen er direkte tilsetning av hydrogen til karbon. Kull varmes opp under trykk i nærvær av hydrogen og et flytende produkt oppnås, som deretter bearbeides til flybensin og motordrivstoff. Jernoksid brukes som katalysator, samt katalysatorer basert på tinn og molybden. Under krigen ble det oppnådd omtrent 1400 tonn flytende drivstoff per dag ved 12 tyske fabrikker ved bruk av Bergius-prosessen.
En annen prosess, Fischer - Tropsch, består av to stadier. Først forgasses kullet, d.v.s. utføre sin reaksjon med vanndamp og oksygen og få en blanding av hydrogen og karbonoksider. Denne blandingen omdannes til flytende drivstoff ved hjelp av katalysatorer som inneholder jern eller kobolt. Med slutten av krigen ble produksjonen av syntetisk brensel fra kull i Tyskland avviklet.
Som et resultat av økningen i oljeprisen som fulgte etter oljeembargoen i 1973-1974, ble det gjort kraftige anstrengelser for å utvikle en økonomisk levedyktig metode for å produsere bensin fra kull. Direkte flytendegjøring av kull kan således utføres mer effektivt ved å bruke en totrinnsprosess der kullet først bringes i kontakt med en aluminiumoksyd-kobolt-molybden-katalysator ved en relativt lav og deretter ved en høyere temperatur. Kostnaden for slik syntetisk bensin er høyere enn den som oppnås fra olje.
Ammoniakk. En av de enkleste hydrogeneringsprosessene fra et kjemisk synspunkt er syntesen av ammoniakk fra hydrogen og nitrogen. Nitrogen er et veldig inert stoff. For å koble fra N-N dets molekyl krever en energi i størrelsesorden 200 kcal/ mol. Imidlertid binder nitrogen seg til overflaten av jernkatalysatoren i atomtilstand, og dette krever bare 20 kcal./ mol. Hydrogen binder seg enda lettere til jern. Syntesen av ammoniakk fortsetter som følger: Dette eksemplet illustrerer evnen til en katalysator til å akselerere både forover- og bakreaksjonene likt, dvs. det faktum at katalysatoren ikke endrer likevektsposisjonen til den kjemiske reaksjonen.Hydrogenering av vegetabilsk olje.
En av de viktigste hydrogeneringsreaksjonene i praksis er ufullstendig hydrogenering av vegetabilske oljer til margarin, matolje og andre matprodukter. Vegetabilske oljer er hentet fra soyabønner, bomullsfrø og andre avlinger. De inkluderer estere, nemlig triglyserider av fettsyrer med varierende grad av umettethet. Oljesyre CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH har en C=C dobbeltbinding, linolsyre har to, og linolensyre har tre. Tilsetning av hydrogen for å bryte denne bindingen hindrer oljene i å oksidere (harskning). Dette øker deres smeltepunkt. Hardheten til de fleste av de oppnådde produktene avhenger av graden av hydrogenering. Hydrogenering utføres i nærvær av et fint pulver av nikkel avsatt på et substrat eller Raney-nikkelkatalysator i en høyt renset hydrogenatmosfære.Dehydrogenering. Dehydrogenering er også en industrielt viktig katalytisk reaksjon, selv om omfanget av dens anvendelse er uforlignelig mindre. Med dens hjelp oppnås for eksempel styren, en viktig monomer. For å gjøre dette, dehydrogener etylbenzen i nærvær av en katalysator som inneholder jernoksid; kalium og noe strukturstabilisator bidrar også til reaksjonen. I industriell skala dehydrogeneres propan, butan og andre alkaner. Dehydrogenering av butan i nærvær av en aluminiumoksyd-kromkatalysator produserer butener og butadien.syrekatalyse.
Den katalytiske aktiviteten til en stor klasse katalysatorer skyldes deres sure egenskaper. I følge I. Bronsted og T. Lowry er en syre en forbindelse som er i stand til å donere et proton. Sterke syrer donerer enkelt protonene sine til baser. Begrepet surhet ble videreutviklet i verkene til G. Lewis, som definerte en syre som et stoff som er i stand til å akseptere et elektronpar fra et donorstoff med dannelse av en kovalent binding på grunn av sosialiseringen av dette elektronparet. Disse ideene, sammen med ideer om reaksjoner som danner karbeniumioner, bidro til å forstå mekanismen til forskjellige katalytiske reaksjoner, spesielt de som involverer hydrokarboner.
Dette eksemplet illustrerer evnen til en katalysator til å akselerere både forover- og bakreaksjonene likt, dvs. det faktum at katalysatoren ikke endrer likevektsposisjonen til den kjemiske reaksjonen.Hydrogenering av vegetabilsk olje.
En av de viktigste hydrogeneringsreaksjonene i praksis er ufullstendig hydrogenering av vegetabilske oljer til margarin, matolje og andre matprodukter. Vegetabilske oljer er hentet fra soyabønner, bomullsfrø og andre avlinger. De inkluderer estere, nemlig triglyserider av fettsyrer med varierende grad av umettethet. Oljesyre CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH har en C=C dobbeltbinding, linolsyre har to, og linolensyre har tre. Tilsetning av hydrogen for å bryte denne bindingen hindrer oljene i å oksidere (harskning). Dette øker deres smeltepunkt. Hardheten til de fleste av de oppnådde produktene avhenger av graden av hydrogenering. Hydrogenering utføres i nærvær av et fint pulver av nikkel avsatt på et substrat eller Raney-nikkelkatalysator i en høyt renset hydrogenatmosfære.Dehydrogenering. Dehydrogenering er også en industrielt viktig katalytisk reaksjon, selv om omfanget av dens anvendelse er uforlignelig mindre. Med dens hjelp oppnås for eksempel styren, en viktig monomer. For å gjøre dette, dehydrogener etylbenzen i nærvær av en katalysator som inneholder jernoksid; kalium og noe strukturstabilisator bidrar også til reaksjonen. I industriell skala dehydrogeneres propan, butan og andre alkaner. Dehydrogenering av butan i nærvær av en aluminiumoksyd-kromkatalysator produserer butener og butadien.syrekatalyse.
Den katalytiske aktiviteten til en stor klasse katalysatorer skyldes deres sure egenskaper. I følge I. Bronsted og T. Lowry er en syre en forbindelse som er i stand til å donere et proton. Sterke syrer donerer enkelt protonene sine til baser. Begrepet surhet ble videreutviklet i verkene til G. Lewis, som definerte en syre som et stoff som er i stand til å akseptere et elektronpar fra et donorstoff med dannelse av en kovalent binding på grunn av sosialiseringen av dette elektronparet. Disse ideene, sammen med ideer om reaksjoner som danner karbeniumioner, bidro til å forstå mekanismen til forskjellige katalytiske reaksjoner, spesielt de som involverer hydrokarboner. Styrken til en syre kan bestemmes ved hjelp av et sett med baser som endrer farge når et proton tilsettes. Det viser seg at noen industrielt viktige katalysatorer oppfører seg som veldig sterke syrer. Disse inkluderer en Friedel-Crafts katalysator som f.eks
HCl-AlCl 2 O 3 (eller HAlCl 4 ), og aluminosilikater. Styrken til syren er en svært viktig egenskap, siden den bestemmer protoneringshastigheten, et nøkkeltrinn i prosessen med syrekatalyse.Aktiviteten til katalysatorer som aluminosilikater som brukes i oljekrakking bestemmes av tilstedeværelsen av Bronsted- og Lewis-syrer på overflaten. Deres struktur er lik strukturen til silika (silisiumdioksid), hvor noen av atomene
Si 4+ erstattet av atomer Al3+. Den overskytende negative ladningen som oppstår i dette tilfellet kan nøytraliseres av de tilsvarende kationene. Hvis kationene er protoner, oppfører aluminosilikatet seg som en Brønsted-syre: Aktiviteten til sure katalysatorer bestemmes av deres evne til å reagere med hydrokarboner med dannelse av et karbeniumion som et mellomprodukt. Alkylkarbeniumioner inneholder et positivt ladet karbonatom bundet til tre alkylgrupper og/
eller hydrogenatomer. De spiller en viktig rolle som mellomprodukter dannet i mange reaksjoner som involverer organiske forbindelser. Virkningsmekanismen til sure katalysatorer kan illustreres ved eksemplet med isomeriseringsreaksjonenn
-butan til isobutan i nærvær av HCl - AlCl 3 eller Pt - Cl - Al 2 O 3 . Først en liten mengde olefin C 4 H 8 fester et positivt ladet hydrogenion til en sur katalysator for å danne m tertiært karbeniumion. Deretter negativt ladet hydridion H - delt av fra n
-butan for å danne isobutan og sekundær butylkarb e ingen d-ion. Siste som et resultat av omorganisering blir tertiær karbon ion. Denne kjeden kan fortsette med eliminering av et hydridion fra neste molekyln- butan, etc.:
Aktiviteten til sure katalysatorer bestemmes av deres evne til å reagere med hydrokarboner med dannelse av et karbeniumion som et mellomprodukt. Alkylkarbeniumioner inneholder et positivt ladet karbonatom bundet til tre alkylgrupper og/
eller hydrogenatomer. De spiller en viktig rolle som mellomprodukter dannet i mange reaksjoner som involverer organiske forbindelser. Virkningsmekanismen til sure katalysatorer kan illustreres ved eksemplet med isomeriseringsreaksjonenn
-butan til isobutan i nærvær av HCl - AlCl 3 eller Pt - Cl - Al 2 O 3 . Først en liten mengde olefin C 4 H 8 fester et positivt ladet hydrogenion til en sur katalysator for å danne m tertiært karbeniumion. Deretter negativt ladet hydridion H - delt av fra n
-butan for å danne isobutan og sekundær butylkarb e ingen d-ion. Siste som et resultat av omorganisering blir tertiær karbon ion. Denne kjeden kan fortsette med eliminering av et hydridion fra neste molekyln- butan, etc.:  viktig o at tertiære karbeniumioner er mer stabile enn primære eller sekundære. Som et resultat er de hovedsakelig tilstede på katalysatoroverflaten, og derfor er hovedproduktet av butanisomerisering isobutan.
viktig o at tertiære karbeniumioner er mer stabile enn primære eller sekundære. Som et resultat er de hovedsakelig tilstede på katalysatoroverflaten, og derfor er hovedproduktet av butanisomerisering isobutan. Syrekatalysatorer er mye brukt i oljeraffinering - krakking, alkylering, polymerisering og isomerisering av hydrokarboner
(se også KJEMI OG METODER FOR OLJERAFINERING). Virkningsmekanismen til karbeniumioner, som spiller rollen som katalysatorer i disse prosessene, er etablert. Samtidig deltar de i en rekke reaksjoner, inkludert dannelsen av små molekyler ved å splitte store, kombinasjonen av molekyler (olefin med olefin eller olefin med isopafin), strukturell omorganisering ved isomerisering, dannelse av parafiner og aromatiske hydrokarboner ved hydrogenoverføring.En av de siste industrielle bruksområdene for syrekatalyse er produksjon av blyholdig drivstoff ved tilsetning av alkoholer til isobutylen eller isoamylen. Tilsetning av oksygenholdige forbindelser til bensin reduserer konsentrasjonen av karbonmonoksid i avgassene. Metyl-
tert -butyleter (MTBE) med et blandingsoktantal på 109 gjør det også mulig å oppnå høyoktandrivstoffet som kreves for drift av en bilmotor med høyt kompresjonsforhold uten å ty til introduksjon av tetraetylbly i bensin. Det er også organisert produksjon av drivstoff med oktantall 102 og 111.Grunnleggende katalyse. Aktiviteten til katalysatorer bestemmes av deres grunnleggende egenskaper. Et gammelt og velkjent eksempel på slike katalysatorer er natriumhydroksid som brukes til å hydrolysere eller forsåpe fett ved fremstilling av såpe, og et nylig eksempel er katalysatorene som brukes i produksjon av polyuretanplast og skum. Uretan dannes ved interaksjon av alkohol med isocyanat, og denne reaksjonen akselereres i nærvær av basiskaminer. Under reaksjonen er basen festet til karbonatomet i isocyanatmolekylet, som et resultat av at en negativ ladning vises på nitrogenatomet og dens aktivitet med hensyn til alkohol øker. En spesielt effektiv katalysator er trietylendiamin. Polyuretanplast oppnås ved å reagere diisocyanater med polyoler (polyalkoholer). Når isocyanatet reagerer med vann, brytes det tidligere dannede uretanet ned og frigjøres CO2 . Når en blanding av polyalkoholer og vann interagerer med diisocyanater, skummer det resulterende polyuretanskum med gassformig CO2. Dobbeltvirkende katalysatorer. Disse katalysatorene fremskynder to typer reaksjoner og gir bedre resultater enn å føre reaktantene i serie gjennom to reaktorer som hver inneholder bare én type katalysator. Dette skyldes det faktum at de aktive stedene til den dobbeltvirkende katalysatoren er svært nær hverandre, og mellomproduktet dannet på en av dem blir umiddelbart til sluttproduktet på den andre.Å kombinere en hydrogenaktiverende katalysator med en hykatalysator gir et godt resultat. Aktiveringen av hydrogen utføres av noen metaller, og isomeriseringen av hydrokarboner av syrer. En effektiv dobbeltvirkende katalysator brukt i oljeraffinering for å omdanne nafta til bensin er fint dispergert platina avsatt på sur alumina. Omdannelsen av naftakomponenter som metylcyklopentan (MCP) til benzen øker oktantallet i bensin. Først dehydrogeneres MCP på platinadelen av katalysatoren til et olefin med samme karbon-ryggrad; deretter går olefinet til den sure delen av katalysatoren, hvor det isomeriserer til cykloheksen. Sistnevnte går over til platinadelen og dehydrogeneres til benzen og hydrogen.
Dobbeltvirkende katalysatorer akselererer oljereformeringen betydelig. De brukes til å isomerisere normale parafiner til isopafiner. Sistnevnte, som koker ved samme temperaturer som bensinfraksjoner, er verdifulle fordi de har et høyere oktantall sammenlignet med rene hydrokarboner. I tillegg kommer transformasjonen
n -butan til isobutan er ledsaget av dehydrogenering, som bidrar til produksjonen av MTBE.Stereospesifikk polymerisering. En viktig milepæl i historien katalyse kom i stand oppdagelsen av katalytisk polymerisasjonen-olefiner med formasjonen stereoregulær x polymer ov. Til katalysatorer stereospesifikk polymerisasjon ble oppdaget av K. Ziegler da han prøvde å forklare de uvanlige egenskapene til polymerene han oppnådde. En annen kjemiker, J. Natta, antydet at det unike med Ziegler-polymerer bestemmes av deres stereoregularitet. Røntgendiffraksjonseksperimenter har vist at polymerer fremstilt fra propylen i nærvær av Ziegler-katalysatorer er svært krystallinske og faktisk har en stereoregulær struktur. For å beskrive slike ordnede strukturer introduserte Natta begrepene " isotaktisk ' og 'syndiotaktisk'. I tilfellet der det ikke er noen ordre, brukes begrepet "ataktisk": En stereospesifikk reaksjon fortsetter på overflaten av faste katalysatorer som inneholder overgangsmetaller fra gruppene IVA - VIII (som Ti, V, Cr, Zr ), som er i en ufullstendig oksidert tilstand, og enhver forbindelse som inneholder karbon eller hydrogen, som er assosiert med et metall fra gruppene I-III . Et klassisk eksempel på en slik katalysator er bunnfallet som dannes under interaksjonen TiCl 4 og Al(C 2 H 5 ) 3 i heptan, hvor titan reduseres til den trivalente tilstanden. Detteusedvanlig aktivsystemet katalyserer polymerisasjonen av propylen ved normal temperatur og trykk.katalytisk oksidasjon.
Bruken av katalysatorer for å kontrollere kjemien i oksidasjonsprosesser er av stor vitenskapelig og praktisk betydning. I noen tilfeller må oksidasjonen være fullstendig, for eksempel ved nøytralisering av CO- og hydrokarbonforurensninger i bileksos.Oftere er det imidlertid ønskelig at oksidasjonen er ufullstendig, for eksempel i mange av prosessene som er mye brukt i industrien for omdannelse av hydrokarboner til verdifulle mellomprodukter som inneholder funksjonelle grupper som -CHO, -COOH, -C-CO, - CN. I dette tilfellet brukes både homogene og heterogene katalysatorer. Et eksempel på en homogen katalysator er et overgangsmetallkompleks som brukes til å oksiderepar
-xylen til tereftalsyre, hvis estere tjener som grunnlag for produksjon av polyesterfibre.Heterogene oksidasjonskatalysatorer.
Disse katalysatorene er vanligvis komplekse faste oksider. Katalytisk oksidasjon skjer i to trinn. Først blir oksidoksygen fanget opp av et hydrokarbonmolekyl adsorbert på oksidoverflaten. Hydrokarbonet oksideres og oksidet reduseres. Det reduserte oksidet reagerer med oksygen og går tilbake til sin opprinnelige tilstand. Ved å bruke en vanadiumkatalysator oppnås ftalsyreanhydrid ved delvis oksidasjon av naftalen eller butan.Etylenproduksjon ved metandehydrodimerisering.
Syntesen av etylen gjennom dehydrodimerisering gjør at naturgass kan omdannes til lettere transporterbare hydrokarboner. reaksjon 2CH 4 + 2O 2® C 2 H 4 + 2H 2 O utføres ved 850 ° Med bruk av ulike katalysatorer; best resultat oppnådd med katalysator Li - MgO . Antagelig går reaksjonen gjennom dannelsen av et metylradikal ved å spalte et hydrogenatom fra et metanmolekyl. Spaltning utføres av ufullstendig redusert oksygen, for eksempel O 2
2-
. Metylradikaler i gassfasen rekombinerer for å danne et etanmolekyl og omdannes til etylen under påfølgende dehydrogenering. Et annet eksempel på ufullstendig oksidasjon er omdannelsen av metanol til formaldehyd i nærvær av en sølv- eller jern-molybdenkatalysator.Zeolitter. Zeolitter utgjør en spesiell klasse av heterogene katalysatorer. Dette er aluminosilikater med en ordnet bikakestruktur, hvis cellestørrelse er sammenlignbar med størrelsen på mange organiske molekyler. De kalles også molekylsikter. Av størst interesse er zeolitter, hvis porer er dannet av ringer bestående av 8–12 oksygenioner (fig. 2). Noen ganger overlapper porene hverandre, som i ZSM-5-zeolitten (fig. 3), som brukes til den svært spesifikke omdannelsen av metanol til bensinfraksjonshydrokarboner. Bensin inneholder betydelige mengder aromatiske hydrokarboner og har derfor et høyt oktantall. I New Zealand, for eksempel, oppnås en tredjedel av all bensin som forbrukes ved hjelp av denne teknologien. Metanol er hentet fra importert metan.
Katalysatorer som utgjør gruppen av Y-zeolitter øker effektiviteten av katalytisk cracking betydelig på grunn av deres uvanlige sure egenskaper. Å erstatte aluminosilikater med zeolitter gjør det mulig å øke utbyttet av bensin med mer enn 20 %.
En stereospesifikk reaksjon fortsetter på overflaten av faste katalysatorer som inneholder overgangsmetaller fra gruppene IVA - VIII (som Ti, V, Cr, Zr ), som er i en ufullstendig oksidert tilstand, og enhver forbindelse som inneholder karbon eller hydrogen, som er assosiert med et metall fra gruppene I-III . Et klassisk eksempel på en slik katalysator er bunnfallet som dannes under interaksjonen TiCl 4 og Al(C 2 H 5 ) 3 i heptan, hvor titan reduseres til den trivalente tilstanden. Detteusedvanlig aktivsystemet katalyserer polymerisasjonen av propylen ved normal temperatur og trykk.katalytisk oksidasjon.
Bruken av katalysatorer for å kontrollere kjemien i oksidasjonsprosesser er av stor vitenskapelig og praktisk betydning. I noen tilfeller må oksidasjonen være fullstendig, for eksempel ved nøytralisering av CO- og hydrokarbonforurensninger i bileksos.Oftere er det imidlertid ønskelig at oksidasjonen er ufullstendig, for eksempel i mange av prosessene som er mye brukt i industrien for omdannelse av hydrokarboner til verdifulle mellomprodukter som inneholder funksjonelle grupper som -CHO, -COOH, -C-CO, - CN. I dette tilfellet brukes både homogene og heterogene katalysatorer. Et eksempel på en homogen katalysator er et overgangsmetallkompleks som brukes til å oksiderepar
-xylen til tereftalsyre, hvis estere tjener som grunnlag for produksjon av polyesterfibre.Heterogene oksidasjonskatalysatorer.
Disse katalysatorene er vanligvis komplekse faste oksider. Katalytisk oksidasjon skjer i to trinn. Først blir oksidoksygen fanget opp av et hydrokarbonmolekyl adsorbert på oksidoverflaten. Hydrokarbonet oksideres og oksidet reduseres. Det reduserte oksidet reagerer med oksygen og går tilbake til sin opprinnelige tilstand. Ved å bruke en vanadiumkatalysator oppnås ftalsyreanhydrid ved delvis oksidasjon av naftalen eller butan.Etylenproduksjon ved metandehydrodimerisering.
Syntesen av etylen gjennom dehydrodimerisering gjør at naturgass kan omdannes til lettere transporterbare hydrokarboner. reaksjon 2CH 4 + 2O 2® C 2 H 4 + 2H 2 O utføres ved 850 ° Med bruk av ulike katalysatorer; best resultat oppnådd med katalysator Li - MgO . Antagelig går reaksjonen gjennom dannelsen av et metylradikal ved å spalte et hydrogenatom fra et metanmolekyl. Spaltning utføres av ufullstendig redusert oksygen, for eksempel O 2
2-
. Metylradikaler i gassfasen rekombinerer for å danne et etanmolekyl og omdannes til etylen under påfølgende dehydrogenering. Et annet eksempel på ufullstendig oksidasjon er omdannelsen av metanol til formaldehyd i nærvær av en sølv- eller jern-molybdenkatalysator.Zeolitter. Zeolitter utgjør en spesiell klasse av heterogene katalysatorer. Dette er aluminosilikater med en ordnet bikakestruktur, hvis cellestørrelse er sammenlignbar med størrelsen på mange organiske molekyler. De kalles også molekylsikter. Av størst interesse er zeolitter, hvis porer er dannet av ringer bestående av 8–12 oksygenioner (fig. 2). Noen ganger overlapper porene hverandre, som i ZSM-5-zeolitten (fig. 3), som brukes til den svært spesifikke omdannelsen av metanol til bensinfraksjonshydrokarboner. Bensin inneholder betydelige mengder aromatiske hydrokarboner og har derfor et høyt oktantall. I New Zealand, for eksempel, oppnås en tredjedel av all bensin som forbrukes ved hjelp av denne teknologien. Metanol er hentet fra importert metan.
Katalysatorer som utgjør gruppen av Y-zeolitter øker effektiviteten av katalytisk cracking betydelig på grunn av deres uvanlige sure egenskaper. Å erstatte aluminosilikater med zeolitter gjør det mulig å øke utbyttet av bensin med mer enn 20 %. I tillegg er zeolitter selektive med hensyn til størrelsen på de reagerende molekylene. Selektiviteten deres skyldes størrelsen på porene som molekyler av bare visse størrelser og former kan passere gjennom. Dette gjelder både utgangsmaterialer og reaksjonsprodukter. For eksempel på grunn av steriske restriksjoner
par -xylen dannes lettere enn mer voluminøstorto- og meta -isomerer. Sistnevnte er "låst" i porene til zeolitten (fig. 4).Bruken av zeolitter har gjort en reell revolusjon i noen industrielle teknologier - avvoksing av gassolje og maskinolje, oppnåelse av kjemiske mellomprodukter for produksjon av plast ved alkylering av aromatiske forbindelser, xylenisomerisering, disproporsjonering av toluen og katalytisk krakking av olje. Zeolitt er spesielt effektiv her
ZSM-5. Katalysatorer og miljøvern. Bruken av katalysatorer for å redusere luftforurensning begynte på slutten 19 40-tallet. I 1952 fant A. Hagen-Smith at hydrokarboner og nitrogenoksider, som er en del av avgasser, reagerer på lys og danner oksidanter (spesielt ozon), som irriterer øynene og gir andre uønskede effekter. Omtrent på samme tid utviklet Y. Houdry en metode for katalytisk rensing av eksosgasser ved å oksidere CO og hydrokarboner opp til CO 2 og H 2 A. I 1970 ble Clean Air Declaration (revidert 1977, utvidet 1990) formulert som krever at alle nye kjøretøy fra 1975-modeller skal være utstyrt med katalysatorer. Det er etablert normer for sammensetningen av avgasser. Siden blyforbindelser tilsatt bensingiftkatalysatorer, har et utfasingsprogram blitt vedtatt. Det ble også gjort oppmerksom på behovet for å redusere innholdet av nitrogenoksider.Katalysatorer er laget spesielt for bilomformere, der aktive komponenter avsettes på et keramisk underlag med en bikakestruktur, gjennom cellene som eksosgasser passerer. Underlaget er belagt med for eksempel et tynt lag av metalloksid
Al2O3 som en katalysator påføres på - platina, palladium eller rhodium. Innholdet av nitrogenoksider som dannes ved forbrenning av naturlig brensel ved termiske kraftverk kan reduseres ved å tilsette små mengder ammoniakk til røykgassene og lede dem gjennom en titan-vanadium-katalysator.Enzymer. Enzymer er naturlige katalysatorer som regulerer biokjemiske prosesser i en levende celle. De deltar i prosessene med energiutveksling, nedbryting av næringsstoffer, biosyntesereaksjoner. Mange komplekse organiske reaksjoner kan ikke fortsette uten dem. Enzymer fungerer ved vanlig temperatur og trykk, har svært høy selektivitet og er i stand til å øke reaksjonshastigheten med åtte størrelsesordener. Til tross for disse fordelene er det kun ca. Av de 15 000 kjente enzymene brukes 20 i stor skala.Mennesket har brukt enzymer i tusenvis av år for å bake brød, produsere alkoholholdige drikker, ost og eddik. Nå brukes enzymer også i industrien: i prosessering av sukker, i produksjon av syntetiske antibiotika, aminosyrer og proteiner. Proteolytiske enzymer som akselererer hydrolyseprosesser tilsettes vaskemidler.
Ved hjelp av bakterier
Clostridium acetobutylicum H. Weizmann utførte den enzymatiske omdannelsen av stivelse til aceton og butylalkohol. Denne metoden for å oppnå aceton ble mye brukt i England under første verdenskrig, og under andre verdenskrig ble butadiengummi laget med dens hjelp i USSR.En usedvanlig stor rolle ble spilt av bruken av enzymer produsert av mikroorganismer for syntese av penicillin, samt streptomycin og vitamin
B12. Enzymatisk produsert etylalkohol er mye brukt som drivstoff til biler. I Brasil kjører mer enn en tredjedel av de rundt 10 millioner bilene på 96 % etylalkohol fra sukkerrør, og resten på en blanding av bensin og etylalkohol (20 %). Teknologien for produksjon av drivstoff, som er en blanding av bensin og alkohol, er godt utviklet i USA. I 1987 ble ca. 4 milliarder liter alkohol, hvorav cirka 3,2 milliarder liter ble brukt som drivstoff. Ulike applikasjoner finnes også i den såkalte. immobiliserte enzymer. Disse enzymene er assosiert med en fast bærer, slik som silikagel, som reagensene føres over. Fordelen med denne metoden er at den sikrer effektiv kontakt av substratene med enzymet, separering av produkter og konservering av enzymet. Et eksempel på industriell bruk av immobiliserte enzymer er isomerisering D -glukose til fruktose. TEKNOLOGISKE ASPEKTER Moderne teknologier kan ikke tenkes uten bruk av katalysatorer. Katalytiske reaksjoner kan foregå ved temperaturer opp til 650° C og trykk på 100 atm eller mer. Dette gjør det nødvendig å løse problemene knyttet til kontakten mellom gassformige og faste stoffer og med overføring av katalysatorpartikler på en ny måte. For at prosessen skal være effektiv, må modelleringen ta hensyn til de kinetiske, termodynamiske og hydrodynamiske aspektene. Datamodellering er mye brukt her, samt nye instrumenter og metoder for å kontrollere teknologiske prosesser.På 1960-tallet ble det gjort betydelige fremskritt i produksjonen av ammoniakk. Bruken av en mer aktiv katalysator gjorde det mulig å senke temperaturen på hydrogenproduksjonen under dekomponeringen av vanndamp, på grunn av hvilket det var mulig å senke trykket og følgelig redusere produksjonskostnadene, for eksempel ved bruk av billigere sentrifugalkompressorer. Som et resultat falt kostnadene for ammoniakk med mer enn halvparten, det var en enorm økning i produksjonen, og i forbindelse med dette - en økning i matproduksjonen, siden ammoniakk er en verdifull gjødsel.
Metoder. Forskning innen katalyse utføres ved bruk av både tradisjonelle og spesielle metoder. Radioaktive merker, røntgen, infrarød og Raman (Raman) spektroskopi, elektronmikroskopi metoder brukes; kinetiske målinger utføres, påvirkningen av metodene for å oppnå katalysatorer på deres aktivitet studeres. Av stor betydning er bestemmelsen av overflatearealet til katalysatoren ved Brunauer-Emmett-Teller-metoden (BET-metoden), basert på måling av fysisk nitrogenadsorpsjon ved forskjellige trykk. For å gjøre dette, bestemme mengden nitrogen som kreves for dannelsen av et monolag på overflaten av katalysatoren, og kjenn til diameteren til molekylet N 2 , beregne det totale arealet. I tillegg til å bestemme det totale overflatearealet, utføres kjemisorpsjon av ulike molekyler, noe som gjør det mulig å estimere antall aktive sentre og få informasjon om deres egenskaper.Forskere har til disposisjon ulike metoder for å studere overflatestrukturen til katalysatorer på atomnivå. Unik informasjon lar deg få en metode
EXAFS . Blant de spektroskopiske metodene brukes UV-, røntgen- og Auger-fotoelektronspektroskopi i økende grad. Av stor interesse er sekundær ionemassespektrometri og ionespredningsspektroskopi. NMR-målinger brukes til å studere naturen til katalytiske komplekser. Skanningstunnelmikroskopet lar deg se arrangementet av atomer på overflaten av katalysatoren. PERSPEKTIV Omfanget av katalytiske prosesser i industrien øker hvert år. Katalysatorer brukes i økende grad for å nøytralisere miljøgifter. Katalysatorers rolle i produksjonen av hydrokarboner og oksygenholdig syntetisk brensel fra gass og kull vokser. Det virker veldig lovende å lage brenselceller for økonomisk konvertering av brenselenergi til elektrisk energi.Nye konsepter for katalyse vil gjøre det mulig å oppnå polymere materialer og andre produkter med mange verdifulle egenskaper, forbedre energiproduksjonsmetoder, øke matproduksjonen, spesielt ved å syntetisere proteiner fra alkaner og ammoniakk ved hjelp av mikroorganismer. Det kan være mulig å utvikle genetisk konstruerte metoder for produksjon av enzymer og organometalliske forbindelser som nærmer seg naturlige biologiske katalysatorer i deres katalytiske aktivitet og selektivitet.
LITTERATUR Gates B.K. Kjemi av katalytiske prosesser . M., 1981Boreskov G.K. Katalyse. Spørsmål om teori og praksis . Novosibirsk, 1987
Gankin V.Yu., Gankin Yu.V.Ny generell teori om katalyse . L., 1991
Tokabe K. Katalysatorer og katalytiske prosesser . M., 1993
S. I. LEVCHENKOV
FYSISK OG KOLLOID KJEMI
Sammendrag av forelesninger for studenter ved Fakultet for biologi ved Southern Federal University (RSU)
2.3 KATALYTISKE PROSESSER
Hastigheten til en kjemisk reaksjon ved en gitt temperatur bestemmes av dannelseshastigheten til det aktiverte komplekset, som igjen avhenger av verdien av aktiveringsenergien. I mange kjemiske reaksjoner kan strukturen til det aktiverte komplekset inkludere stoffer som ikke er støkiometrisk reaktanter; Selvfølgelig, i dette tilfellet, endres også verdien av aktiveringsenergien til prosessen. Ved tilstedeværelse av flere overgangstilstander vil reaksjonen hovedsakelig forløpe langs banen med den laveste aktiveringsbarrieren.
Katalyse er fenomenet med å endre hastigheten på en kjemisk reaksjon i nærvær av stoffer hvis tilstand og mengde forblir uendret etter reaksjonen.
Skille positivt og negativ katalyse (henholdsvis en økning og reduksjon i reaksjonshastigheten), selv om uttrykket "katalyse" ofte betyr bare positiv katalyse; negativ katalyse kalles hemming.
Et stoff som er en del av strukturen til et aktivert kompleks, men som ikke er støkiometrisk en reaktant, kalles en katalysator. Alle katalysatorer er karakterisert ved slike generelle egenskaper som spesifisitet og virkningsselektivitet.
Spesifisitet Katalysatoren ligger i dens evne til å akselerere bare én reaksjon eller en gruppe reaksjoner av samme type og ikke påvirke hastigheten på andre reaksjoner. For eksempel er mange overgangsmetaller (platina, kobber, nikkel, jern, etc.) katalysatorer for hydrogeneringsprosesser; aluminiumoksid katalyserer hydreringsreaksjoner, etc.
Selektivitet katalysator - evnen til å akselerere en av de parallelle reaksjonene som er mulig under gitte forhold. På grunn av dette er det mulig, ved å bruke forskjellige katalysatorer, å oppnå forskjellige produkter fra de samme utgangsmaterialene:
|
: CO + H 2 ––> CH 3 OH |
: C 2 H 5 OH --> C 2 H 4 + H 2 O |
|
: CO + H 2 --> CH 4 + H 2 O |
: C 2 H 5 OH --> CH 3 CHO + H 2 |
Årsaken til økningen i reaksjonshastigheten med positiv katalyse er reduksjonen i aktiveringsenergien når reaksjonen fortsetter gjennom det aktiverte komplekset med deltakelse av katalysatoren (fig. 2.8).
Siden, i henhold til Arrhenius-ligningen, er hastighetskonstanten til en kjemisk reaksjon eksponentielt avhengig av aktiveringsenergien, forårsaker en reduksjon i sistnevnte en betydelig økning i hastighetskonstanten. Faktisk, hvis vi antar at de pre-eksponentielle faktorene i Arrhenius-ligningen (II.32) for katalytiske og ikke-katalytiske reaksjoner er nærme, så kan vi skrive for forholdet mellom hastighetskonstanter:
Hvis ΔE A = –50 kJ/mol, vil forholdet mellom hastighetskonstantene være 2,7·10 6 ganger (i praksis øker faktisk en slik reduksjon i E A reaksjonshastigheten med omtrent 10 5 ganger).
Det skal bemerkes at tilstedeværelsen av en katalysator ikke påvirker størrelsen på endringen i det termodynamiske potensialet som et resultat av prosessen, og derfor, ingen katalysator kan gjøre en termodynamisk umulig prosess spontan (av en prosess hvis ΔG (ΔF) er større enn null). Katalysatoren endrer ikke verdien av likevektskonstanten for reversible reaksjoner; effekten av katalysatoren i dette tilfellet består bare i å akselerere oppnåelsen av en likevektstilstand.
Avhengig av fasetilstanden til reaktantene og katalysatoren, skilles homogen og heterogen katalyse.

Ris. 2.8 Energidiagram av en kjemisk reaksjon uten katalysator (1)
og i nærvær av en katalysator (2).
2.3.1 Homogen katalyse.
Homogen katalyse er en katalytisk reaksjon der reaktantene og katalysatoren er i samme fase. Ved homogene katalytiske prosesser danner katalysatoren reaktive mellomprodukter med reagensene. Vurder en reaksjon
A + B ––> C
I nærvær av en katalysator utføres to raske trinn, som resulterer i dannelsen av partikler av mellomproduktet AA og deretter (via det aktiverte komplekset AVK #) det endelige reaksjonsproduktet med katalysatorregenerering:
A + K ––> AK
AK + V --> C + K
Et eksempel på en slik prosess er dekomponering av acetaldehyd, hvis aktiveringsenergi er E A = 190 kJ/mol:
CH 3 CHO -–> CH 4 + CO
I nærvær av joddamp fortsetter denne prosessen i to trinn:
CH 3 CHO + I 2 ––> CH 3 I + HI + CO
CH 3 I + HI --> CH 4 + I 2
Reduksjonen i aktiveringsenergien til denne reaksjonen i nærvær av en katalysator er 54 kJ/mol; i dette tilfellet øker reaksjonshastighetskonstanten omtrent med en faktor på 105. Den vanligste typen homogen katalyse er syrekatalyse, hvor hydrogenioner H + fungerer som en katalysator.
2.3.2 Autokatalyse.
Autokatalyse- prosessen med katalytisk akselerasjon av en kjemisk reaksjon av et av produktene. Et eksempel er hydrolyse av estere katalysert av hydrogenioner. Syren som dannes under hydrolyse dissosieres med dannelsen av protoner, som akselererer hydrolysereaksjonen. Et trekk ved den autokatalytiske reaksjonen er at denne reaksjonen fortsetter med en konstant økning i konsentrasjonen av katalysatoren. Derfor, i den innledende perioden av reaksjonen, øker hastigheten, og i påfølgende stadier, som et resultat av en reduksjon i konsentrasjonen av reagenser, begynner hastigheten å synke; den kinetiske kurven til produktet av en autokatalytisk reaksjon har en karakteristisk S-formet form (fig. 2.9).

Ris. 2.9 Kinetisk kurve for det autokatalytiske reaksjonsproduktet
2.3.3 Heterogen katalyse.
heterogen katalyse - katalytiske reaksjoner som oppstår i grensesnittet mellom fasene som dannes av katalysatoren og reaktantene. Mekanismen for heterogene katalytiske prosesser er mye mer komplisert enn ved homogen katalyse. I hver heterogen katalytisk reaksjon kan minst seks stadier skilles:
1. Diffusjon av utgangsmaterialer til katalysatoroverflaten.
2. Adsorpsjon av utgangsmaterialer på overflaten med dannelse av en eller annen mellomforbindelse:
A + B + K --> AVK
3. Aktivering av den adsorberte tilstanden (energien som kreves for dette er prosessens sanne aktiveringsenergi):
AVK ––> AVK #
4. Dekomponering av det aktiverte komplekset med dannelse av adsorberte reaksjonsprodukter:
ABK # ––> CDK
5. Desorpsjon av reaksjonsprodukter fra katalysatoroverflaten.
СDК ––> С + D + К
6. Diffusjon av reaksjonsprodukter fra katalysatoroverflaten.
Et spesifikt trekk ved heterokatalytiske prosesser er katalysatorens evne til å bli fremmet og forgiftet.
Forfremmelse- en økning i aktiviteten til katalysatoren i nærvær av stoffer som ikke i seg selv er katalysatorer for denne prosessen (promotere). For eksempel for en reaksjon katalysert av metallisk nikkel
CO + H 2 --> CH 4 + H 2 O
innføringen av en liten urenhet av cerium i nikkelkatalysatoren fører til en kraftig økning i aktiviteten til katalysatoren.
Forgiftning- en kraftig reduksjon i aktiviteten til katalysatoren i nærvær av visse stoffer (såkalte katalytiske giftstoffer). For eksempel, for ammoniakksyntesereaksjonen (katalysator - jernsvamp), forårsaker tilstedeværelsen av oksygen eller svovelforbindelser i reaksjonsblandingen en kraftig reduksjon i aktiviteten til jernkatalysatoren; samtidig avtar evnen til katalysatoren til å adsorbere de opprinnelige stoffene svært lite.
For å forklare disse trekkene ved heterogene katalytiske prosesser, gjorde G. Taylor følgende antakelse: ikke hele overflaten av katalysatoren er katalytisk aktiv, men bare noen av dens seksjoner - den såkalte. aktive sentre , som kan være forskjellige defekter i krystallstrukturen til katalysatoren (for eksempel fremspring eller fordypninger på overflaten av katalysatoren). For tiden er det ingen enhetlig teori om heterogen katalyse. For metallkatalysatorer, a multiplett-teori . Hovedbestemmelsene til multiplettteorien er som følger:
1. Katalysatorens aktive senter er et sett av et visst antall adsorpsjonssentre plassert på overflaten av katalysatoren i geometrisk samsvar med strukturen til molekylet som gjennomgår transformasjon.
2. Når reagerende molekyler adsorberes på det aktive senteret, dannes et multiplettkompleks, som et resultat av at bindingene omfordeles, noe som fører til dannelse av reaksjonsprodukter.
Teorien om multipletter kalles noen ganger teorien om geometrisk likhet mellom det aktive senteret og reagerende molekyler. For forskjellige reaksjoner er antallet adsorpsjonssentre (som hver er identifisert med et metallatom) i det aktive senteret forskjellig - 2, 3, 4, etc. Slike aktive sentre kalles henholdsvis dublett, triplett, firing osv. (i det generelle tilfellet en multiplett, som teorien skylder navnet sitt til).
For eksempel, i henhold til teorien om multipletter, skjer dehydrogeneringen av mettede monohydriske alkoholer på en dublett, og dehydrogeneringen av cykloheksan - på en sekstett (fig. 2.10 - 2.11); Multippelteorien gjorde det mulig å relatere den katalytiske aktiviteten til metaller til deres atomradius.
 Ris. 2.10 Dehydrogenering av alkoholer på en dublett
Ris. 2.10 Dehydrogenering av alkoholer på en dublett
 Ris. 2.11 Dehydrogenering av cykloheksan på en sekstett
Ris. 2.11 Dehydrogenering av cykloheksan på en sekstett
2.3.4 Enzymatisk katalyse.
Enzymatisk katalyse - katalytiske reaksjoner som oppstår med deltakelse av enzymer - biologiske katalysatorer av proteinnatur. Enzymatisk katalyse har to karakteristiske trekk:
1. høy aktivitet , som er flere størrelsesordener høyere enn aktiviteten til uorganiske katalysatorer, noe som forklares med en svært betydelig reduksjon i aktiveringsenergien til prosessen med enzymer. Så hastighetskonstanten for reaksjonen av dekomponering av hydrogenperoksid katalysert av Fe 2+ ioner er 56 s -1; hastighetskonstanten for samme reaksjon katalysert av enzymet katalase er 3,5·10 7, dvs. reaksjonen i nærvær av enzymet går en million ganger raskere (aktiveringsenergiene til prosessene er henholdsvis 42 og 7,1 kJ/mol). Hastighetskonstantene for ureahydrolyse i nærvær av syre og urease varierer med tretten størrelsesordener, og utgjør 7,4·10 -7 og 5,10 6 s -1 (aktiveringsenergien er henholdsvis 103 og 28 kJ/mol).
2. Høy spesifisitet . For eksempel katalyserer amylase nedbrytningen av stivelse, som er en kjede av identiske glukoseenheter, men katalyserer ikke hydrolysen av sukrose, hvis molekyl er sammensatt av glukose- og fruktosefragmenter.
I henhold til allment aksepterte ideer om mekanismen for enzymatisk katalyse, er substrat S og enzym F i likevekt med et meget raskt dannet enzym-substratkompleks FS, som spaltes relativt sakte til reaksjonsproduktet P med frigjøring av fritt enzym; således er trinnet for dekomponering av enzym-substratkomplekset til reaksjonsprodukter hastighetsbestemmende (begrensende).
F+S<––>FS ––> F+P
Studiet av avhengigheten av hastigheten til den enzymatiske reaksjonen på konsentrasjonen av substratet ved en konstant konsentrasjon av enzymet viste at med en økning i konsentrasjonen av substratet, øker reaksjonshastigheten først og slutter deretter å endre seg (fig. 2.12) og reaksjonshastighetens avhengighet av konsentrasjonen av substratet er beskrevet av følgende ligning:
 (II.45)
(II.45)
Introduksjon
1. Generelle bestemmelser og regelmessigheter for katalyse
2. Homogen katalyse
3. Syre- og basekatalyse
4. Homogene katalytiske reaksjoner katalysert av komplekse forbindelser
5. Enzymatisk katalyse
6. Heterogen katalyse
Konklusjon
Liste over kilder som er brukt
Introduksjon
Katalyse er fenomenet med en endring i hastigheten på en reaksjon i nærvær av katalysatorer. Reaksjoner som involverer katalysatorer kalles katalytiske. Stoffer som øker hastigheten på en kjemisk reaksjon, mens de forblir uendret som følge av den totale reaksjonen, kalles katalysatorer.
Det finnes mange forskjellige typer katalysatorer og mange forskjellige virkningsmekanismer. Katalysatoren går gjennom sykluser der den først bindes, deretter regenereres, bindes igjen og så videre mange ganger. Katalysatoren lar reaksjonen forløpe på en annen måte, og med en raskere hastighet enn den gjør i fravær av en katalysator. Hastigheten kan økes ved å senke aktiveringsenergien, øke den preeksponensielle faktoren, eller begge deler.
Katalysatoren akselererer samtidig både forover- og bakreaksjonene, slik at likevektskonstanten for den totale reaksjonen forblir uendret. Hvis dette ikke var tilfelle, ville det vært mulig å konstruere en evighetsmaskin ved å bruke en katalysator for å regenerere materie
1. Generelle bestemmelser og regelmessigheter for katalyse
Katalysatorer er delt inn i homogene og heterogene. En homogen katalysator er i samme fase med reaktantene, en heterogen danner en uavhengig fase atskilt med et grensesnitt fra fasen der reaktantene er lokalisert. Typiske homogene katalysatorer er syrer og baser. Metaller, deres oksider og sulfider brukes som heterogene katalysatorer.
Reaksjoner av samme type kan fortsette med både homogene og heterogene katalysatorer. Sammen med sure løsninger brukes derfor fast Al 2 O 3 , TiO 2 , ThO 2 , aluminosilikater og zeolitter med sure egenskaper. Heterogene katalysatorer med grunnleggende egenskaper: CaO, BaO, MgO.
Heterogene katalysatorer har som regel en høyt utviklet overflate, for hvilken de er fordelt på en inert bærer (silikagel, alumina, aktivert karbon, etc.).
For hver type reaksjon er bare visse katalysatorer effektive. I tillegg til de syre-base som allerede er nevnt, er det oksidasjons-reduksjonskatalysatorer; de er karakterisert ved tilstedeværelsen av et overgangsmetall eller dets forbindelse (Co +3, V 2 O 5 +, MoO 3). I dette tilfellet utføres katalyse ved å endre oksidasjonstilstanden til overgangsmetallet.
Mange reaksjoner utføres ved hjelp av katalysatorer som virker gjennom koordinering av reaktanter ved atomet eller ionet til overgangsmetallet (Ti, Rh, Ni). Slik katalyse kalles koordinasjonskatalyse.
Hvis katalysatoren har chirale egenskaper, oppnås et optisk aktivt produkt fra et optisk inaktivt substrat.
I moderne vitenskap og teknologi brukes ofte systemer med flere katalysatorer, som hver akselererer forskjellige stadier av reaksjonen. Katalysatoren kan også øke hastigheten til ett av trinnene i den katalytiske syklus utført av en annen katalysator. Det er her "katalyse av katalyse" eller andrenivåkatalyse finner sted.
Enzymer spiller rollen som katalysatorer i biokjemiske reaksjoner.
Katalysatorer må skilles fra initiativtakere. For eksempel brytes peroksider ned til frie radikaler som kan sette i gang radikale kjedereaksjoner. Initiatorer forbrukes under reaksjonen, så de kan ikke betraktes som katalysatorer.
Hemmere blir noen ganger feilaktig betraktet som negative katalysatorer. Men inhibitorer, som radikale kjedereaksjoner, reagerer med frie radikaler og, i motsetning til katalysatorer, blir de ikke bevart. Andre hemmere (katalytiske giftstoffer) binder seg til katalysatoren og deaktiverer den, som er katalyseundertrykkelse snarere enn negativ katalyse. Negativ katalyse er umulig i prinsippet: det ville gi en langsommere vei for reaksjonen, men reaksjonen vil selvfølgelig gå langs en raskere, i dette tilfellet, ikke katalysert, vei.
Katalysatoren kan være et av reaksjonsproduktene. I dette tilfellet kalles reaksjonen autokatalytisk, og selve fenomenet kalles autokatalyse. For eksempel under oksidasjonen av Fe 2+ med Mn0 4
5Fe 2+ + Mn0 4 - + 8H+ \u003d 5Fe 3+ + Mn 2+ + 4H 2 0
de resulterende Mn2+-ionene katalyserer reaksjonsforløpet.
Katalytiske reaksjoner er ekstremt vanlige i naturen. Den mest overraskende av disse er reaksjoner med enzymer, som katalyserer mange reaksjoner i levende organismer. Katalysatorer er mye brukt i industrien. Produksjon av salpeter- og svovelsyrer, ammoniakk, produksjon av syntetisk gummi m.m. umulig uten katalytiske reaksjoner. Katalysatorer brukes i produksjonen av medisinske stoffer: fenacetin, guaiakol, halogenderivater av aromatiske forbindelser, etc. Mn(IV), Ni, Co, Fe, A1C1 3 , TeC1 3 oksider brukes som katalysatorer.
Det er homogen og heterogen katalyse, men for noen av dem er hovedregelmessighetene som følger:
1. Katalysatoren deltar aktivt i den elementære handlingen av reaksjonen, og danner enten mellomliggende forbindelser med en av deltakerne i reaksjonen, eller et aktivert kompleks med alle reaktanter. Etter hver elementær handling blir den regenerert og kan samhandle med nye molekyler av reagerende stoffer.
2. Hastigheten til en katalytisk reaksjon er proporsjonal med mengden katalysator.
3. Katalysatoren har virkningsselektivitet. Det kan endre hastigheten på en reaksjon og ikke påvirke hastigheten til en annen.
4. Katalysatoren lar reaksjonen forløpe på en annen måte, og med en raskere hastighet enn den gjør i fravær av en katalysator.
Hastigheten kan økes ved å senke aktiveringsenergien, øke den preeksponensielle faktoren, eller begge deler. For eksempel blir den termiske nedbrytningen av acetaldehyd CH 3 CHO CH 4 + CO katalysert av joddamp, som forårsaker en reduksjon i aktiveringsenergien med ~55 kJ/mol. Denne nedgangen forårsaker en økning i hastighetskonstanten med en faktor på omtrent 10 000.
5. Katalysatoren påvirker ikke plasseringen av termodynamisk likevekt. Det endrer like mye hastigheten på både forover- og bakoverreaksjoner.
6. Når visse stoffer, kalt promotorer, tilsettes, øker aktiviteten til katalysatoren; tilsetning av inhibitorer reduserer reaksjonshastigheten.
2. Homogen katalyse
I homogen katalyse er katalysatoren et molekyl eller ion i en homogen løsning. Ved homogen katalyse danner katalysatoren og alle reaktanter én felles fase.
Hovedantakelsen til teorien om homogen katalyse er ideen om at det i løpet av reaksjonen dannes ustabile mellomforbindelser av katalysatoren med reaktantene, som deretter brytes ned med regenereringen av katalysatoren:
A + B + K = (A-B-K)* D + K
Hastigheten på denne reaksjonen
v=k nc ENc Bc K
er proporsjonal med katalysatorkonsentrasjonen, og hastighetskonstanten følger Arrhenius-ligningen. Denne reaksjonen kan foregå i to stadier:
katalyse homogen syre enzymatisk heterogen
I dette tilfellet er to tilfeller mulig. I det første trinnet er nedbrytningshastigheten av komplekset til katalysatoren og det opprinnelige produktet mye høyere enn hastigheten til det andre trinnet, der sluttproduktet dannes. Derfor er konsentrasjonen av komplekser, kalt Arrhenius-komplekser i denne typen katalyse, lav. I det andre tilfellet er nedbrytningshastigheten av komplekset i samsvar med hastigheten til det andre trinnet. Konsentrasjonen av mellomkomplekset er betydelig og stasjonær. Komplekser av denne typen kalles van't Hoff-komplekser.
Det andre tilfellet, som mer typisk, vil bli vurdert mer detaljert. Siden mellomproduktet AA er i likevekt med utgangsmaterialene, må hastighetene for de direkte (v 1) og omvendte (v 2) reaksjonene (1) være like. Ved å kompilere kinetiske ligninger for dem får vi:
hvor (Med Til"-- Med AK") er konsentrasjonen av katalysatoren som ikke reagerte; Med EN,Med AK"-- likevektskonsentrasjoner av henholdsvis stoff A og mellomforbindelse AA.
Fra (2) finner vi konsentrasjonen av mellomproduktet:
Den totale hastigheten for hele prosessen (v) bestemmes av hastigheten til det tregeste trinnet, i dette tilfellet det andre. Deretter
Ved å erstatte i (4) konsentrasjonen av mellomproduktet (3), får vi:
Ligning (5) indikerer muligheten for eksistensen av to begrensende regimer:
I begge tilfeller er reaksjonshastigheten direkte proporsjonal med konsentrasjonen av katalysatoren, men reaksjonsrekkefølgen for utgangsmaterialene er forskjellig. I det første tilfellet er det lik to, og i det andre - til en. Utenfor de begrensende regimene vil rekkefølgen av reaksjonen være brøkdel.
Et eksempel på homogen katalyse er reaksjonen av termisk dekomponering av acetaldehyd CH 3 CH 4 + CO, katalysert av joddamp. I fravær av joddamp E en=191,0 kJ/mol, i deres nærvær E en= 136,0 kJ/mol. Hastighetskonstanten øker med en faktor på 10 000. Dette er fordi reaksjonen går i to trinn:
CH 3 SON + I 2 \u003d CH 3 I + HI + CO
CH 3 I + HI \u003d CH 4 + I 2
Aktiveringsenergien for hvert trinn er mindre enn aktiveringsenergien til den ikke-katalytiske reaksjonen.
Homogen katalyse inkluderer mange syre-basereaksjoner, kompleksdannelsesreaksjoner, redoksreaksjoner, tallrike hydrogenering, sulfateringsreaksjoner, etc.
3. Syre- og basekatalyse
Syrer og baser i mange reaksjoner fungerer som en katalysator, dvs. deltar i reaksjonen, de selv blir ikke konsumert (reaksjoner av hydrolyse, alkylering, esterifisering, etc. Det er tre typer syre-base katalyse:
1) spesifikk sur (basisk) katalyse, hvori henholdsvis H+- eller OH-ioner tjener som katalysator;
2) total syre (base) katalyse, som utføres av enhver protondonor (akseptor);
3) elektrofil (nukleofil) katalyse utført av Lewis-syrer og baser.
Første ordens rate konstant k for reaksjonen i en bufferløsning kan være en lineær funksjon av [H + ], [OH - ], [HA], [A - ], dvs.:
k \u003d k 0 + k 1 [H+] + k 2 [OH -] + k 3 [ON] + k 4 [A -]
I dette uttrykket k 0 -- hastighetskonstant av første orden i fravær av alle katalytiske ioner: [H + ], [OH - ], [NA], [A - ], a k t -- katalytiske koeffisienter.
Hvis bare begrepet k 1 [H + ] spiller en betydelig rolle, så sier de at reaksjonen manifesterer seg i spesifikk katalyse av hydrogenioner. Hvis et medlem dominerer k 3 [HA], reaksjonen sies å være gjenstand for generell syrekatalyse. Dersom medlemmet dominerer k 4 [A - ], så sies reaksjonen å være gjenstand for virkningen av en felles basekatalyse.
For spesifikk syre-base-katalyse når hastigheten på den ikke-katalytiske reaksjonen er lav (k 0 = 0) kan representeres i logaritmisk form:
For sure løsninger:
For alkaliske løsninger:
Ligningene indikerer at i tilfelle av spesifikk syre-base katalyse, avhenger logaritmen til hastighetskonstanten lineært av pH i mediet.
Mekanismen for den katalytiske virkningen av hydrogenioner er at en mellomforbindelse av et proton og et molekyl av det opprinnelige stoffet dannes. På grunn av denne prosessen løsnes de kjemiske bindingene som er tilstede i det opprinnelige stoffet, aktiveringsenergien reduseres, og deretter brytes den protonerte formen av BH + ned til et reaksjonsprodukt og en katalysator.
4. Homogene katalytiske reaksjoner katalysert av komplekse forbindelser
Reaksjonene med reduksjon, hydrogenering, oksidasjon, isomerisering, polymerisering under industrielle forhold utføres i nærvær av katalysatorer - komplekse forbindelser (metallioner fra gruppe VIII i det periodiske systemet Fe, Co, Ni, Ru, samt Cu, Fg Hg, Cr, Mn). Essensen av den katalytiske virkningen ligger i det faktum at metallioner fungerer som elektrondonorer eller akseptorer. Den kjemiske interaksjonen mellom reagerende molekyler koordinert rundt det sentrale metallionet forenkles av polarisering av molekylene og en reduksjon i energien til individuelle bindinger. Det sentrale metallionet er en bro som letter elektroniske overganger mellom reagerende molekyler.
Den katalytiske aktiviteten til et metallion avhenger av ionets bindingsenergi med deltakerne i reaksjonen. Hvis bindingsenergien er høy eller lav, viser metallionet svak katalytisk aktivitet. I det første tilfellet er metallionene så sterkt bundet til de reagerende molekylene at de fjernes fra reaksjonen. I det andre tilfellet kan ikke de reagerende molekylene fortrenge andre ligander som er tilstede i løsningen. Koordinasjonsmettede komplekser oppnås, som ikke er aktive katalysatorer.
På grunn av de brede mulighetene for å regulere sammensetningen av komplekse katalysatorer, ble det mulig å simulere en rekke reaksjoner som involverer enzymer som inneholder ioner av gruppe VIII-elementer.
5. Enzymatisk katalyse
Enzymer er de mest fantastiske katalysatorene. Mange reaksjoner i levende organismer er forbundet med dem, og derfor kalles de ofte biologiske katalysatorer. Enzymatisk katalyse er et mer komplekst fenomen enn konvensjonell katalyse. Den høye organiseringen av enzymatiske katalyseprosesser bestemmes av det særegne ved interaksjon i en levende organisme, assosiert med en spesiell kombinasjon av den molekylære strukturen til enzymer og substrater, som kalles reaktanter i enzymatiske reaksjoner.
Enzymer er proteiner, dvs. består av aminosyrer knyttet sammen med peptidbindinger. Enzymmolekylet har alternerende polare grupper COOH, NH 2 , NH, OH, SH, etc., samt hydrofobe grupper. Den primære strukturen til et enzym bestemmes av rekkefølgen av veksling av de forskjellige aminosyrene. Som et resultat av termisk kaotisk bevegelse, bøyer enzymmakromolekylet seg og spoler seg til løse spoler. Intermolekylær interaksjon oppstår mellom individuelle deler av polypeptidkjeden, noe som fører til dannelse av hydrogenbindinger. Den sekundære strukturen til enzymet vises i form av et løst medium. For hvert enzym er den sekundære strukturen ganske bestemt. Det aktive katalytiske senteret til enzymet inkluderer grupper som orienterer substratmolekylene i en bestemt posisjon. Det aktive senteret er som en matrise, som bare kan inneholde et molekyl med en viss struktur. Mekanismen for enzymatisk katalyse består i samspillet mellom de aktive stedene til enzymet med substratet for å danne et enzym-substratkompleks, som deretter gjennomgår flere transformasjoner, som et resultat av at et reaksjonsprodukt vises. Hvert av de mellomliggende trinnene er preget av en lavere aktiveringsenergi, noe som bidrar til rask fremdrift av reaksjonen. Dette forklarer den høye aktiviteten til enzymer.
Enzymer deles inn i klasser avhengig av hvilken type reaksjon de katalyserer: oksidoreduktaser (katalyserer redoksreaksjoner), transferaser (katalyserer overføring av kjemiske grupper fra en forbindelse til en annen), hydrolaser (katalyserer hydrolysereaksjoner), lyaser (bryter ulike bindinger) , isomeraser (utfører isomere transformasjoner), ligaser (katalyserer syntesereaksjoner). Som man kan se, er enzymer forskjellige i spesifisitet og selektivitet. Noen katalyserer en hel klasse av reaksjoner av en bestemt type, noen katalyserer bare én reaksjon.
Mange enzymer inneholder metallioner (metallenzymer). I metalloenzymer danner metallioner chelatkomplekser som gir den aktive strukturen til enzymet. Metaller med variabel grad av oksidasjon (Fe, Mn, Cu) deltar i redoksreaksjoner, og utfører overføringen av elektroner til oksidasjonsmidlet. Det er kjent flere titalls organiske forbindelser som utfører funksjonene hydrogen og elektronoverføring. De inneholder derivater av vitaminer.
Tungmetallioner (Ag + , Hg + , Pb 2+) kan blokkere de aktive enzymgruppene.
For å vurdere virkningen av ulike enzymer ble begrepet molekylær aktivitet introdusert, som bestemmes av antall substratmolekyler som omdannes under virkningen av ett enzymmolekyl per minutt. Det mest aktive av de kjente enzymene er karbonsyreanhydrase, hvis molekylære aktivitet er ~36 millioner molekyler per minutt.
Hastigheten av en reaksjon katalysert av et enzym er direkte proporsjonal med konsentrasjonen av enzymet. Ved lav substratkonsentrasjon er reaksjonen av første orden i forhold til substratet. Ved høye konsentrasjoner forblir reaksjonshastigheten konstant og reaksjonsrekkefølgen blir null (enzymet er fullstendig mettet med substratet). Reaksjonshastigheten avhenger av temperaturen og surheten til mediet.
Enzymatisk katalyse spiller en stor rolle i alle manifestasjoner av livet, der vi snakker om levende vesener. For å øke kroppens vitale aktivitet og forbedre stoffskiftet er det laget mange enzympreparater som brukes som medisiner. Enzympreparater er mye brukt for brudd på funksjonen til mage-tarmkanalen forbundet med utilstrekkelig produksjon av fordøyelsesenzymer. Så i noen former for gastritt brukes pepsin- eller pankreatinpreparater. Enzymer brukes også med hell i tilfeller der det er nødvendig å ødelegge store mengder proteinformasjoner (for brannskader, purulente sår, purulente inflammatoriske sykdommer i lungene, etc.). I disse tilfellene brukes protolytiske enzymer, noe som fører til rask hydrolyse av proteiner og letter resorpsjonen av purulente ansamlinger. For behandling av en rekke infeksjonssykdommer brukes lysozympreparater som ødelegger membranen til noen patogene bakterier. Enzymer som løser opp blodpropp (blodpropp inne i blodårer) er svært viktige. Dette er plasmin som finnes i blodet; bukspyttkjertelenzymer - trypsin og chymotrypsin. På grunnlag av dem, med forskjellige tilsetningsstoffer, er det laget medisinske enzympreparater - streptokinase, streptase og andre som brukes i medisin.
6. Heterogen katalyse
Heterogen katalyse utføres ved grensesnittet. Den første observerte heterogene katalytiske reaksjonen ble utført ved Priestley (1778) dehydrering av etylalkohol på aktiv leire:
C 2 H 5 OH -- C 2 H 4 + H 2 O
I første halvdel av 1800-tallet ble et stort antall verk viet heterogen katalyse. Mange arbeider har blitt viet til den teoretiske forklaringen av den katalytiske virkningen til et fast stoff. I fremtiden gikk utviklingen av doktrinen både langs veien med å akkumulere eksperimentelle data, utvikle metoder for å forberede katalysatorer, oppdage og studere nye katalytiske prosesser, introdusere katalyse i den kjemiske industrien og langs veien for å utvikle teorien om heterogen katalyse. . Imidlertid var suksessen til teoretikerne mye mer beskjeden enn suksessen til eksperimenterne. Og dette er ingen tilfeldighet.
Selv om det ikke er noen grunnleggende forskjell mellom katalytiske og ikke-katalytiske prosesser, som begge følger lovene for kjemisk kinetikk, går systemet med reagerende stoffer i begge tilfeller gjennom en spesiell aktiv tilstand, spesifikke trekk observeres i heterogene katalytiske reaksjoner. Først av alt dukker det opp en solid kropp, på egenskapene som alle fenomener som helhet i hovedsak avhenger av. Derfor er det ikke tilfeldig at fremskrittene i teorien om heterogen katalyse er uløselig knyttet til utviklingen av teorien om faste stoffer. Siden prosessen foregår på overflaten, er kunnskap om strukturen til katalysatoroverflaten avgjørende for utviklingen av teorien om katalyse. Av dette følger en nær sammenheng mellom utviklingen av teorien om katalyse og utviklingen av den eksperimentelle og teoretiske studien av adsorpsjonsfenomener. Kompleksiteten til heterogene prosesser og deres iboende spesifisitet fører til at teoretisk forskning på dette området ennå ikke er fullført. Så langt kan vi snakke om eksistensen av flere teoretiske konsepter som i en første tilnærming generaliserer visse eksperimentelle fakta.
I praksis oppstår to typer heterogen katalyse oftest:
1) prosesser, hvis katalysator er i fast fase, og reaktantene er i flytende fase;
2) prosesser, hvis katalysator er i fast fase, og reaktantene er i gassfase. Reaksjonen skjer som regel (og i noen flertrinnsprosesser begynner) ved fasegrensen, dvs. på overflaten av en solid kropp - en katalysator.
Den heterogene prosessen kan deles inn i fem stadier:
1) transport av reaktanter til katalysatoroverflaten (diffusjon);
2) adsorpsjon av reaktanter på katalysatoroverflaten;
3) reaksjon på overflaten;
4) desorpsjon av reaksjonsprodukter med frigjøring av katalysatoroverflaten;
5) transport av reaksjonsprodukter inn i volumet (diffusjon).
Avhengig av betingelsene for prosessen og dens egenskaper, kan hvilket som helst av de fem stadiene være de tregeste, og følgelig kan hastigheten på den katalytiske prosessen begrenses av hvilken som helst av dem. For en sammenlignende vurdering av aktiviteten til katalysatorer, er den avgjørende faktoren reaksjonshastigheten på overflaten. Derfor, i de tilfellene hvor det er viktig å oppnå verdien av aktiviteten til katalysatoren, prøver de å gjennomføre prosessen på en slik måte at hastigheten bestemmes av det andre, såkalte kinetiske trinnet.
Adsorpsjon og desorpsjon har sine egne lover Adsorpsjon er prosessen med spontan endring i konsentrasjonen av et stoff på grenseflaten. Stoffet hvis overflate adsorpsjon finner sted kalles adsorbent. Adsorbenten kalles adsorbat. Ved heterogen katalyse er adsorbenten katalysatoren, og adsorbatet er molekylet til reaktanten (substratet). Adsorpsjon av substratet på katalysatoren kan utføres på grunn av vekselvirkningskreftene som oppstår mellom molekylene (atomene) til katalysatoren lokalisert på overflaten og molekylene i substratet (fysisk adsorpsjon). En kjemisk interaksjon (kjemisk adsorpsjon eller kjemisorpsjon) kan oppstå mellom molekylene (atomene) til katalysatoren og molekylene i reaktanten. Som et resultat av adsorpsjon øker rekkefølgen av systemet, systemets energi reduseres, og aktiveringsenergien til reaksjonen avtar.
For heterogene prosesser er bevegelsen av et stoff fra det indre volumet av en væske eller gass til en fast overflate av spesiell betydning. Masseoverføringsprosesser adlyder diffusjonslovene.
Konklusjon
Betydningen av katalysatorer og katalytiske prosesser i oljeraffinering og petrokjemi kan ikke overvurderes. Tross alt er de grunnlaget for teknisk fremgang på de viktigste områdene for å møte behovene til det moderne menneskelige samfunn. Poenget er for det første at olje fra ulike felt vanligvis bare inneholder 5 til 20 % lettkokende fraksjoner tilsvarende bensin. Behovet for bensin med den moderne utviklingen av bil- og lufttransport er enormt. Samtidig viser motordrivstoff destillert direkte fra olje seg vanligvis å være av dårlig kvalitet. Bruken av katalytisk krakking og reformering i kombinasjon med andre moderne prosesseringsmetoder gjør det mulig å øke utbyttet av høyaktive bensiner med opptil 75 % av oljevekten. Motordrivstoff oppnås også ved katalytisk hydrogenering av kull ved bruk av metallkatalysatorer.
Videre katalytisk prosessering av hydrokarboner på metall- og oksidkatalysatorer gjør det mulig å oppnå mellomprodukter som er nødvendige i produksjonen av forbruksvarer. De fleste monomerer og polymerer avledet fra dem er produkter fra katalytiske prosesser for behandling av hydrokarboner og deres derivater hentet fra olje, kull, skifer og naturgass. Katalytiske prosesser spiller en viktig rolle i produksjonen av vaskemidler, fargestoffer for medisinske stoffer.
Den viktigste organiske syntesen som gir mellomprodukter (og produkter av organisk teknologi) er hovedsakelig basert på katalytiske reaksjoner. Av stor betydning i livet til det moderne samfunnet er slike produkter fra den kjemiske industrien som svovelsyre, ammoniakk og salpetersyre. Nesten alle grener av den nasjonale økonomien bruker disse stoffene eller andre kjemiske forbindelser oppnådd med deres hjelp. På grunnlag av dem produseres titalls millioner tonn mineralgjødsel, uten noe som det er umulig å øke eller til og med opprettholde utbyttet av felt. Hundrevis av industrier innen kjemiske, petrokjemiske, mat-, lett- og andre industrier bruker svovelsyre, salpetersyre, ammoniakk og deres derivater. Disse forbindelsene brukes også i metallurgisk og metallbearbeidende industri.
I mellomtiden ble storskala produksjon av svovelsyre, ammoniakk og salpetersyre fra ammoniakk bare mulig takket være oppdagelsen av passende katalysatorer og utviklingen av metoder for deres bruk.
Liste over kilder som er brukt
1) A.P. Belyaev. Fysisk og kolloidal kjemi. M.: GOETAR-Media, 2008
2) I.P. Mukhlenov. Katalysatorteknologi. M.: Bookinist, 2007
3) Kjemisk leksikon. -- M.: Soviet Encyclopedia, 1990.
4) Imyanitov N.S. Systemer av flere katalysatorer i metallkomplekskatalyse. // Koordinasjonskjemi. 1984.
Lignende dokumenter
Essensen og trekk ved prosessen med metallkomplekskatalyse. Egenskaper til metallkomplekser som bestemmer katalytisk aktivitet. Modellering av enzymatisk katalyse. Bruksområder, fordeler og ulemper ved metallkomplekskatalyse.
rapport, lagt til 16.03.2015
Generelle teorier om homogen katalyse. Stadier av katalyseprosessen og reaksjonshastighet. Kinetikk av den katalytiske reaksjonen av disproporsjonering av hydrogenperoksid i nærvær av forskjellige mengder Fe2+ katalysator, effekten av pH på reaksjonshastigheten.
test, lagt til 18.09.2012
Bestemmelse av hastigheten på en kjemisk reaksjon. Oppdagelseshistorie, konsept og typer katalytiske reaksjoner. Meninger fra fremtredende kjemifigurer om fenomenet katalyse, dets fysiske og kjemiske aspekter. Mekanismen for heterogen katalyse. Enzymatisk katalyse i biokjemi.
abstrakt, lagt til 14.11.2010
Begrepene katalyse, katalysator og katalytisk prosess, deres ulike definisjoner. Mekanismer for å akselerere reaksjoner med katalysatorer. Kjemisk (ikke-biologisk) katalyse. Syntese av dietyleter fra alkohol med deltakelse av svovelsyre. Teorier om katalyse.
abstrakt, lagt til 26.01.2009
Metallkatalysatorer, blandede og polyfunksjonelle katalysatorer for heterogen katalyse. Katalysatorkrav. Teorier om heterogen katalyse. Multipleks og elektronisk teori. Teori om aktive ensembler. Katalyse i naturgassbehandling.
semesteroppgave, lagt til 05.06.2014
Definisjon av katalyse og dens rolle i industrien. Selektivitet og generelle ideer om konseptet "mekanisme for en kjemisk reaksjon". Klassifisering av katalytiske systemer etter faser og typer reaksjoner. Adsorpsjon og grunnleggende krav til industrielle katalysatorer.
abstrakt, lagt til 26.01.2009
Metoder for å koke arendiazoniumsalter. Analyse av den termodynamiske surheten til fenoler. Karakterisering av fenolacylering, syrekatalyse og fenoksyeddiksyre. Funksjoner ved Kolbe-Schmitt-reaksjonen, en metode for å oppnå fenoksyeddiksyre.
test, lagt til 28.03.2012
Emnet termokjemi, studiet av de termiske effektene av kjemiske reaksjoner. Typer prosesser for kjemisk kinetikk og katalyse. Entalpi (termisk effekt) av reaksjonen. Reaksjonshastighet, lov om massehandling. Kjemisk likevektskonstant, katalysatoreffekt.
presentasjon, lagt til 19.10.2014
Enzymer (enzymer) er biologiske katalysatorer som brukes i produksjonen av melkesyreprodukter. Internasjonale regler for nomenklaturen av enzymer. Enzymer kan bare være kuleformede proteiner. Proteinstrukturnivåer. Kinetikk for enzymatisk katalyse.
abstrakt, lagt til 26.01.2009
Konseptet med biologiske katalysatorer, virkningen av enzymer i levende systemer og deres klassifisering. Faktorer som påvirker aktiviteten til biologiske katalysatorer. Stoffer som kalles koenzymer. Kinetikk for enzymatisk katalyse, Michaelis-Menten-ligningen.