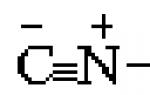Et af de mest almindelige kemiske elementer i langt de fleste kemikalier er ilt. Oxider, syrer, baser, alkoholer, phenoler og andre oxygenholdige forbindelser undersøges i løbet af uorganisk og organisk kemi. I vores artikel vil vi studere egenskaberne samt give eksempler på deres anvendelse inden for industri, landbrug og medicin.
Oxider
Den enkleste struktur er binære forbindelser af metaller og ikke-metaller med ilt. Klassificeringen af oxider omfatter følgende grupper: sure, basiske, amfotere og ligegyldige. Hovedkriteriet for opdeling af alle disse stoffer er, hvilket element der kombineres med ilt. Hvis det er et metal, så tilhører de de vigtigste. For eksempel: CuO, MgO, Na20 - oxider af kobber, magnesium, natrium. Deres vigtigste kemiske egenskab er reaktion med syrer. Så kobberoxid reagerer med chloridsyre:
CuO + 2HCl -> CuCl2 + H2O + 63, 3 kJ.
Tilstedeværelsen af atomer af ikke-metalliske grundstoffer i molekylerne af binære forbindelser indikerer, at de tilhører surt hydrogen H20, carbondioxid CO 2, phosphorpentoxid P 2 O 5. Sådanne stoffers evne til at reagere med alkalier er deres vigtigste kemiske egenskab.
Som et resultat af reaktionen kan der dannes arter: sure eller medium. Dette afhænger af, hvor mange mol alkali reagerer:
- CO2 + KOH => KHCO3;
- CO2 + 2KOH => K2CO3 + H2O.
En anden gruppe af oxygenholdige forbindelser, som omfatter kemiske elementer, såsom zink eller aluminium, omtales som amfotere oxider. Deres egenskaber viser en tendens til kemisk interaktion med både syrer og baser. Produkterne fra interaktionen mellem sure oxider og vand er syrer. For eksempel dannes syrer i reaktionen mellem svovlsyreanhydrid og vand - dette er en af de vigtigste klasser af oxygenholdige forbindelser.
Syrer og deres egenskaber
Forbindelser bestående af hydrogenatomer bundet til komplekse ioner af syrerester er syrer. De kan konventionelt opdeles i uorganiske, for eksempel kulsyre, sulfat, nitrat og organiske forbindelser. Sidstnævnte omfatter eddikesyre, myresyre, oliesyre. Begge grupper af stoffer har lignende egenskaber. Så de går ind i en neutraliseringsreaktion med baser, reagerer med salte og basiske oxider. Næsten alle oxygenholdige syrer i vandige opløsninger dissocierer i ioner, idet de er leder af den anden slags. Det er muligt at bestemme den sure natur af deres miljø på grund af overdreven tilstedeværelse af hydrogenioner ved hjælp af indikatorer. For eksempel bliver lilla lakmus rød, når den tilsættes til en sur opløsning. En typisk organisk forbindelse er eddikesyre indeholdende en carboxylgruppe. Det indeholder et hydrogenatom, der forårsager surt Det er en farveløs væske med en bestemt skarp lugt, der krystalliserer ved temperaturer under 17 ° C. CH3 COOH er ligesom andre oxygenholdige syrer fuldstændig opløseligt i vand i enhver mængde. Dens 3-5% løsning er kendt i hverdagen under navnet eddike, som bruges til madlavning som krydderier. Stoffet har også fundet dets anvendelse i produktionen af acetatsilke, farvestoffer, plast og nogle lægemidler.

Organiske forbindelser indeholdende ilt
I kemi kan der skelnes mellem en stor gruppe stoffer, der ud over kulstof og brint også indeholder iltpartikler. Disse er carboxylsyrer, estere, aldehyder, alkoholer og phenoler. Alle deres kemiske egenskaber bestemmes af tilstedeværelsen i molekylerne i særlige komplekser - funktionelle grupper. For eksempel en alkohol, der kun indeholder begrænsende bindinger mellem atomer - ROH, hvor R er en carbonhydridradikal. Disse forbindelser betragtes normalt som derivater af alkaner, hvor et hydrogenatom erstattes af en hydroxylgruppe.
Alkoholers fysiske og kemiske egenskaber
Den samlede tilstand af alkoholer er flydende eller faste forbindelser. Der er ingen gasformige stoffer blandt alkoholer, hvilket kan forklares ved dannelsen af associerede - grupper bestående af flere molekyler forbundet med svage brintbindinger. Denne kendsgerning bestemmer også den gode opløselighed af lavere alkoholer i vand. Men i vandige opløsninger, iltholdige organiske stoffer - alkoholer, dissocierer ikke i ioner, ændrer ikke farven på indikatorer, det vil sige, at de har en neutral reaktion. Hydrogenatomet i den funktionelle gruppe er svagt bundet til andre partikler, derfor er det i kemiske interaktioner i stand til at forlade molekylets grænser. På stedet for fri valens erstattes den af andre atomer, for eksempel i reaktioner med aktive metaller eller med alkalier, af metalatomer. I nærvær af katalysatorer, såsom et platinumet eller kobber, oxideres alkoholer af kraftige oxidanter - kaliumdichromat eller permanganat til aldehyder.

Forstærkningsreaktion
En af de vigtigste kemiske egenskaber ved iltholdige organiske stoffer: alkoholer og syrer er en reaktion, der fører til produktion af estere. Det er af stor praktisk betydning og bruges i industrien til ekstraktion af estere, der anvendes som opløsningsmidler i fødevareindustrien (i form af frugtessenser). I medicin bruges nogle af esterne som antispasmodika, for eksempel udvider ethylnitrit perifere blodkar, og isoamylnitrit er en beskytter af kranspulsårer. Ligningen for forestringsreaktionen er som følger:
CH3COOH + C2H5OH<--(H2SO4)-->CH3COOC2H5 + H2O
I den er CH3 COOH eddikesyre, og C2H5OH er den kemiske formel for ethanolalkohol.
Aldehyder
Hvis forbindelsen indeholder en funktionel gruppe -COH, tilhører den aldehyder. De præsenteres som produkter til yderligere oxidation af alkoholer, for eksempel ved oxidationsmidler såsom kobberoxid.

Tilstedeværelsen af et carbonylkompleks i molekylerne af myret eller eddikesyre -aldehyd bestemmer deres evne til at polymerisere og vedhæfte atomer fra andre kemiske grundstoffer. Kvalitative reaktioner, der kan bruges til at bevise tilstedeværelsen af en carbonylgruppe og et stofs tilhørsforhold til aldehyder, er reaktionen af et sølvspejl og interaktion med kobberhydroxid ved opvarmning:
Det mest anvendte acetaldehyd bruges i industrien til fremstilling af eddikesyre - et stort tonnageprodukt af organisk syntese.
Egenskaber for iltholdige organiske forbindelser - carboxylsyrer
Tilstedeværelsen af en carboxylgruppe - en eller flere - er et særpræg ved carboxylsyrer. På grund af strukturen i den funktionelle gruppe kan dimerer dannes i sure opløsninger. De er forbundet med hydrogenbindinger. Forbindelser dissocierer i hydrogenkationer og syreresteranioner og er svage elektrolytter. Undtagelsen er den første repræsentant for en række mættede monobasiske syrer - myresyre eller metan, som er en mellemstyrket leder af den anden slags. Tilstedeværelsen af kun simple sigma -bindinger i molekyler angiver grænsen, men hvis stoffer har dobbelt pi -bindinger i deres sammensætning, er det umættede stoffer. Den første gruppe omfatter syrer, såsom metan, eddike, smørsyre. Den anden er repræsenteret af forbindelser, der er en del af flydende fedtstoffer - olier, for eksempel oliesyre. De kemiske egenskaber ved oxygenholdige forbindelser: organiske og uorganiske syrer er meget ens. Så de kan interagere med aktive metaller, deres oxider, alkalier og alkoholer. For eksempel reagerer eddikesyre med natrium, oxid og med dannelsen af et salt - natriumacetat:
NaOH + CH3COOH → NaCH3COO + H2O
Et særligt sted indtages af forbindelser af højere carboxylsyreholdige syrer: stearinsyre og palmitinsyre, med en trihydric mættet alkohol - glycerol. De er estere og kaldes fedtstoffer. De samme syrer er en del af natrium- og kaliumsalte som en syrerest og danner sæber.

Fedtstoffer er vigtige organiske forbindelser, der er udbredt i naturen og spiller en ledende rolle som det mest energiforbrugende stof. De er ikke en individuel forbindelse, men en blanding af forskellige glycerider. Disse er forbindelser af en mættet polyvalent alkohol - glycerol, som ligesom methanol og phenol indeholder hydroxylfunktionelle grupper. Fedtstoffer kan udsættes for hydrolyse - opvarmning med vand i nærvær af katalysatorer: alkalier, syrer, zinkoxider, magnesium. Reaktionsprodukterne er glycerin og forskellige carboxylsyrer, som senere bruges til fremstilling af sæbe. For ikke at bruge dyre naturlige carboxylsyrer i denne proces opnås de ved at oxidere paraffin.

Fenoler
Afslut behandlingen af klasserne af oxygenholdige forbindelser, lad os dvæle ved phenoler. De repræsenteres af phenylradikalet - C6H5, knyttet til en eller flere funktionelle hydroxylgrupper. Den enkleste repræsentant for denne klasse er carbolsyre eller phenol. Som en meget svag syre kan den interagere med alkalier og aktive metaller - natrium, kalium. Et stof med udtalte bakteriedræbende egenskaber - phenol bruges i medicin såvel som til fremstilling af farvestoffer og phenol -formaldehydharpikser.

I vores artikel studerede vi hovedklasserne af iltholdige forbindelser og overvejede også deres kemiske egenskaber.
Sammensætningen af oxygenholdige forbindelser kan omfatte hydroxyl-, carbonyl- og carboxylgrupper. De svarer til klassen af forbindelser - alkoholer, aldehyder, ketoner, carboxylsyrer.
Alkoholer
Lad os handle på ethylen med vand. Svovlsyre bruges som katalysator. Det katalyserer både tilsætning og tilbagetrækning af vand. Som et resultat af brud på dobbeltbindingen vil et carbonatom vedhæfte et hydrogenatom, og det andet - hydroxylgruppen i vandmolekylet. Sådan opnås forbindelser af alkoholklassen.
Den enkleste alkohol er methyl CH3 - OH. Ethylalkohol er den næste homolog for et antal alkoholer.
Hvis alkoholmolekylet indeholder en hydroxylgruppe, kaldes en sådan alkohol monohydrisk. Der er også alkoholer, der indeholder to eller flere hydroxylgrupper. Sådanne alkoholer kaldes polyhydriske. Et eksempel på en polyvalent alkohol er den almindeligt kendte glycerin.
Aldehyder
Under virkningen af et svagt oxidationsmiddel kan en hydroxylgruppe omdannes til en carbonylgruppe. Som et resultat dannes en ny klasse af forbindelser - aldehyder. For eksempel oxideres ethylalkohol af et så svagt oxidationsmiddel som kobber (II) oxid. Reaktionen finder sted ved opvarmning. Reaktionsproduktet er acetaldehyd.
Dette er en kvalitativ reaktion på alkoholer. Det er produceret sådan. Kobbertråden kalcineres til dannelse af en oxidfilm og dyppes i rødglødende tilstand i alkohol. Alkohol oxideres, og kobber reduceres. Kobbertråden bliver skinnende og afgiver lugten af acetaldehyd.
Ligesom alkoholer er aldehyder i stand til at blive oxideret af svage oxidanter. Denne reaktion opstår, når aldehydet oxideres med en ammoniakopløsning af sølvoxid. Det udfældede sølv danner det tyndeste spejllag på reagensglasets vægge. Denne proces kaldes sølvspejlreaktionen. Det bruges til kvalitativ bestemmelse af aldehyder.
Carboxylsyrer
Under oxidationen af aldehyder fester carbonylgruppen et oxygenatom. Dette giver anledning til en carboxylgruppe. En ny klasse af organiske forbindelser dannes - carboxylsyrer. I vores tilfælde blev eddikesyre opnået fra acetaldehyd. Som du kan se, kan funktionelle grupper transformere til hinanden.
Mange carboxylsyrer er svage elektrolytter. Under dissociation under påvirkning af vandmolekyler adskilles hydrogen fra carboxylgruppen i det organiske syremolekyle:
CH3COOH ó CH3COO- + H +
Eddikesyre reagerer ligesom andre organiske syrer med baser, basiske oxider og metaller.
Aldehyder, alkoholer og syrer er af stor betydning i vores liv. De bruges til syntese af forskellige stoffer. Alkoholer bruges til fremstilling af syntetiske gummier, dufte, stoffer, farvestoffer og som opløsningsmidler.
Organiske syrer er udbredt i naturen og spiller en vigtig rolle i biokemiske reaktioner. I den kemiske industri bruges organiske syrer i læderproduktion, i calico -tryk.
Alkoholer er også giftige. Methanol er især giftig. Når det indtages, forårsager det blindhed og endda død af en person. Ethylalkohol har en negativ effekt på vitale centre i hjernebarken, blodkar, på psyken og ødelægger en persons personlighed.
Mål: udvikle evnen til at foretage observationer og drage konklusioner, nedskrive ligningerne for de tilsvarende reaktioner i molekylære og ioniske former .
Beskæftigelsessikkerhed
1. En samling retningslinjer for studerende om implementering af praktiske øvelser og laboratoriearbejde i disciplinen "Kemi".
2. Natriumhydroxidopløsning, natriumcarbonat, calciumcarbonat, kobber (II) oxid, eddikesyre, lakmusblå, zink; reagensglasstativ, vandbad, varmeindretning, tændstikker, reagensglasholder.
Teoretisk materiale
Carboxylsyrer er organiske forbindelser, hvis molekyler indeholder en eller flere carboxylgrupper forbundet til et carbonhydridradikal eller et hydrogenatom.
Opnåelse: I laboratoriet kan carboxylsyrer opnås fra deres salte ved at virke på dem med svovlsyre, når de opvarmes, for eksempel:
2СН 3 - СООNa + H 2 SO 4 ® 2СН 3 - СООН + Na 2 SO 4
I industrien opnås de ved oxidation af kulbrinter, alkoholer og aldehyder.
Kemiske egenskaber:
1. På grund af forskydningen af elektrontætheden fra hydroxylgruppen O - H til stærkt
polariserede carbonylgruppe C = O carboxylsyremolekyler er i stand til
elektrolytisk dissociation: R - COOH → R - COO - + H +
2.Carboxylsyrer har egenskaber, der er karakteristiske for mineralsyrer. De reagerer med aktive metaller, basiske oxider, baser, salte af svage syrer. 2СH 3 COOH + Mg → (CH3 COO) 2 Mg + H2
2СH 3 COOH + СaO → (CH3 COO) 2 Ca + H20
H - COOH + NaOH → H - COONa + H20
2СH 3 CH 2 COOH + Na 2 CO 3 → 2CH 3 CH 2 COONa + H20 + CO 2
CH3CH2 COOH + NaHCO3 → CH3 CH2 COONa + H20 + CO2
Carboxylsyrer er svagere end mange stærke mineralsyrer
CH 3 COONa + H 2 SO 4 (konc.) → CH 3 COOH + NaHSO 4
3. Dannelse af funktionelle derivater:
a) ved interaktion med alkoholer (i nærvær af koncentreret H2S04) dannes estere.
Dannelse af estere ved interaktion mellem en syre og en alkohol i nærværelse af mineralsyrer kaldes en forestringsreaktion. CH 3 - –OH + HO - CH 3 D CH 3 - –OCH 3 + H20
eddikesyre methylmethylester
eddikesyrealkohol
Den generelle formel for estere er R– –OR ’, hvor R og R” er carbonhydridradikaler: i myresyreestere - formater —R = H.
Omvendt reaktion er hydrolyse (forsæbning) af esteren:
CH 3 - –OCH 3 + HO - H DCH 3 - –OH + CH 3 OH.
Glycerin (1,2,3 -trihydroxypropan; 1,2,3 -propantriol) (glycosød) kemisk forbindelse med formlen HOCH2CH (OH) -CH2OH eller C3H5 (OH) 3. Den enkleste repræsentant for trihydric alkoholer. Det er en tyktflydende gennemsigtig væske.
Glycerin er en farveløs, tyktflydende, hygroskopisk væske, uendelig opløselig i vand. Sød smag (glycos - sød). Det opløser mange stoffer godt.
Glycerin er forestret med carboxyl- og mineralsyrer.
Estere af glycerin og højere carboxylsyrer er fedtstoffer.
 Fedtstoffer -
disse er blandinger af estere dannet af den trihydriske alkohol, glycerol og højere fedtsyrer. Generel formel for fedtstoffer, hvor R er radikaler af højere fedtsyrer:
Fedtstoffer -
disse er blandinger af estere dannet af den trihydriske alkohol, glycerol og højere fedtsyrer. Generel formel for fedtstoffer, hvor R er radikaler af højere fedtsyrer:
Oftest inkluderer sammensætningen af fedtstoffer mættede syrer: palmitinsyre C15H31COOH og stearinsyre C17H35COOH og umættede syrer: oliesyre C17H33COOH og linolsyre C17H31COOH.
Det generelle navn for forbindelser af carboxylsyrer med glycerol er triglycerider.

b) når de udsættes for dehydratiserende reagenser som følge af intermolekylær
dehydrering anhydrider dannes
CH 3 - –OH + HO– –CH 3 → CH 3 - –O– –CH 3 + H20
Halogenering. Under virkningen af halogener (i nærvær af rødt fosfor) dannes α-halogenerede syrer:
Anvendelse: i fødevare- og kemiindustrien (produktion af celluloseacetat, hvorfra acetatfiber, organisk glas, film opnås; til syntese af farvestoffer, medicin og estere).
Spørgsmål til konsolidering af teoretisk materiale
1 Hvilke organiske forbindelser er carboxylsyrer?
2 Hvorfor er der ingen gasformige stoffer blandt carboxylsyrer?
3 Hvad forårsager de sure egenskaber af carboxylsyrer?
4 Hvorfor ændrer farven på indikatorerne i eddikesyreopløsningen?
5 Hvilke kemiske egenskaber har glucose og glycerin til fælles, og hvordan adskiller disse stoffer sig fra hinanden? Skriv ligningerne for de tilsvarende reaktioner ned.
Dyrke motion
1. Gennemgå det teoretiske materiale om emnet i den praktiske lektion.
2. Besvar spørgsmål for at konsolidere det teoretiske materiale.
3. Undersøg egenskaberne af iltholdige organiske forbindelser.
4. Udarbejd en rapport.
Instruktioner til implementering
1. Læs sikkerhedsreglerne for arbejde i et kemisk laboratorium og underskriv TB -journal.
2. Udfør eksperimenter.
3. Indtast resultaterne i tabellen.
Oplev nr. 1 Test af eddikesyreopløsning med lakmus
Fortynd den resulterende eddikesyre med en lille mængde vand, og tilsæt et par dråber blå lakmus eller dipindikatorpapir i reagensglasset.
Oplev nr. 2 Reaktion mellem eddikesyre og calciumcarbonat
Hæld lidt kridt (calciumcarbonat) i et reagensglas, og tilsæt en opløsning af eddike
Eksperiment nr. 3 Egenskaber for glucose og saccharose
a) Tilsæt 5 dråber glucoseopløsning, en dråbe kobber (II) saltopløsning til et reagensglas, og under omrystning et par dråber natriumhydroxidopløsning, indtil der dannes en lyseblå opløsning. Dette eksperiment blev udført med glycerin.
b) Opvarm de resulterende opløsninger. Hvad er det du ser?
Oplev nr. 4 Kvalitativ reaktion på stivelse
Tilsæt en dråbe jodalkoholopløsning til 5-6 dråber stivelsespasta i et reagensglas.
Eksempelrapport
Laboratoriearbejde nr. 9 Kemiske egenskaber ved iltholdige organiske forbindelser.
Formål: at danne evnen til at foretage observationer og drage konklusioner, nedskrive ligningerne for de tilsvarende reaktioner i molekylære og ioniske former .
Konklusion skal træffes i overensstemmelse med formålet med arbejdet
Litteratur 0-2 s. 94-98
Laboratoriearbejde nr. 10
Alkoholer- derivater af kulbrinter, der indeholder en funktionel gruppe HAN(hydroxyl). Alkoholer, hvor der er en OH -gruppe, kaldes monatomisk, og alkoholer med flere OH -grupper - polyatomisk.
Navnene på nogle almindelige alkoholer er angivet i tabellen. ni.
Alkoholer kendetegnes ved struktur primær, sekundær og tertiære, afhængigt af hvilket carbonatom (primært, sekundært eller tertiært) er OH -gruppen:
Monohydriske alkoholer er farveløse væsker (op til Cl 2H 25 OH), opløselige i vand. Den enkleste alkohol - methanol CH3OH er ekstremt giftig. Med en stigning i molær masse stiger alkoholers kogepunkt.

Molekyler af flydende monovalente alkoholer ROH er forbundet via hydrogenbindinger:

(disse bindinger er analoge med hydrogenbindinger i rent vand).
Når de er opløst i vand, danner ROH -molekyler hydrogenbindinger med vandmolekyler:

Vandige opløsninger af alkoholer ROH har et neutralt miljø; med andre ord dissocierer alkoholer praktisk talt ikke i en vandig opløsning, hverken surt eller basisk.
De kemiske egenskaber ved monovalente alkoholer skyldes tilstedeværelsen af den funktionelle OH -gruppe i dem.
Hydrogen fra OH -gruppen i alkoholer kan erstattes af et metal:
Ethanolater og derivater af andre alkoholer (alkoholater) let hydrolyseret:
OH -gruppen i alkoholer kan erstattes af Cl eller Br:
Når dehydratiserende midler virker på alkoholer, f.eks. Koncentreret H2S04, intermolekylær dehydrering:
Reaktionsprodukt - diethylether(C 2 H 5) 2 O - tilhører klassen etere.
Under mere alvorlige tilstande bliver dehydrering intramolekylær og den tilsvarende alken dannes:

Polyvalente alkoholer Overvej eksemplet med de enkleste repræsentanter for di- og trihydricalkoholer:

Ved stuetemperatur er de farveløse viskøse væsker med kogepunkter på henholdsvis 198 og 290 ° C og er uendeligt blandbare med vand. Ethylenglycol er giftigt.
De kemiske egenskaber ved polyvalente alkoholer svarer til ROH -alkoholers egenskaber. Så i ethylenglycol kan en eller to OH -grupper erstattes af halogen:

De sure egenskaber ved flerværdige alkoholer manifesteres i det faktum, at (i modsætning til monovalente alkoholer) hydrogenet i OH -gruppen erstattes af et metal under påvirkning af ikke kun metaller, men også metalhydroxider:


(pile i formlen for kobberglycolat viser dannelsen af kovalent kobber - oxygenbindinger ved donor -acceptormekanismen).
Glycerin reagerer på samme måde med kobber (II) hydroxid:

Glykolat og glycerat af kobber (II), som har en lys blå farve, tillader høj kvalitet Find polyvalente alkoholer.
Modtager monovalente alkoholer i industri- hydrering af alkener i nærvær af katalysatorer (H 2 SO 4, Al 2 O 3), og tilsætning af vand til asymmetriske alkener sker i henhold til Markovnikovs regel:
(en metode til opnåelse af en sekundær alkohol) eller tilsætning af CO og H2 til alkener i nærvær af en koboltkatalysator (processen kaldes hydroforming):
(metode til opnåelse primær alkohol).
V laboratorier(og nogle gange i industri) alkoholer opnås ved vekselvirkning mellem halogenerede carbonhydrider og vand eller en vandig alkaliløsning ved opvarmning:

Ethanol C 2 H 5 OH dannes også når alkoholisk gæring sukkerholdige stoffer såsom glucose:
Ethylenglycol produceres i en totrinsproces:
en) ethylenoxidation:

b) hydrering af ethylenoxid:

Glycerin blev tidligere opnået ved forsæbning af fedtstoffer (se 20.3), den moderne tretrinsmetode er den gradvise oxidation af propen (kun et diagram over processen er vist):
Alkoholer bruges som råvarer i organisk syntese, som opløsningsmidler (til lakker, maling osv.), Såvel som i papir-, tryk-, parfume-, farmaceutiske og fødevareindustrien.
Ethers- en klasse af organiske forbindelser, der indeholder et brodannende oxygenatom - O– mellem to carbonhydridradikaler: R - O -R ". Den mest berømte og mest udbredte ether er diethylether C 2 H 5 -O - C 2 H 5. Farveløs, let mobil væske med en karakteristisk ("æterisk") lugt, i laboratoriepraksis kaldes den ganske enkelt ether. Næsten ikke blandbar med vand, balle t = 34,51 ° C. Etherdamp antændes i luften. Få diethylether ved intermolekylær dehydrering af ethanol (se ovenfor), hovedapplikationen er et opløsningsmiddel.
Fenoler- det er alkoholer, hvor OH -gruppen er direkte forbundet med benzenringen. Den enkleste repræsentant er phenol C6H5 -OH. Hvide (bliver lyserøde i lyset) krystaller med en stærk lugt, smeltepunkt = 41 ° C. Forårsager forbrændinger i huden, er giftig.
Phenol er kendetegnet ved en væsentligt højere surhedsgrad end acykliske alkoholer. Som et resultat reagerer phenol i vandig opløsning let med natriumhydroxid:
Derfor det trivielle navn for phenol - carbolsyre.
Bemærk, at OH -gruppen i phenol aldrig erstattes af andre grupper eller atomer, men gør det mere mobil hydrogenatomer i benzenringen. Således reagerer phenol let med brom i vand og salpetersyre og danner henholdsvis 2,4,6-tribromphenol (I) og 2,4,6-trinitrophenol (II, traditionelt navn - picronsyre):

Phenol i industri opnået ved opvarmning af chlorbenzen med natriumhydroxidopløsning under tryk ved 250 ° C:
Phenol bruges som et råmateriale til fremstilling af plast og harpiks, mellemprodukter til maling og lak og farmaceutisk industri, som et desinfektionsmiddel.
10.2. Aldehyder og ketoner
Aldehyder og ketoner Er derivater af carbonhydrider, der indeholder en funktionel carbonylgruppe CO... I aldehyder er carbonylgruppen bundet til et hydrogenatom og et radikal og i ketoner til to radikaler.
Generelle formler:

Navnene på almindelige stoffer i disse klasser er angivet i tabellen. ti.
Methanal er en farveløs gas med en skarp kvælende lugt, let opløselig i vand (det traditionelle navn for en 40% opløsning er formalin), giftig. Efterfølgende medlemmer af den homologe serie af aldehyder er væsker og faste stoffer.
Den enkleste keton er propanon-2, bedre kendt som acetone, ved stuetemperatur - en farveløs væske med en frugtagtig lugt, balle = 56,24 ° C. Blandes godt med vand.
De kemiske egenskaber ved aldehyder og ketoner skyldes tilstedeværelsen af CO -carbonylgruppen; de går let i reaktioner af tilsætning, oxidation og kondens.

Som resultat slutte sig til brint til aldehyder dannet primære alkoholer:
Reduktion med brint ketoner dannet sekundære alkoholer:
Reaktion slutte sig til natriumhydrosulfit bruges til isolering og oprensning af aldehyder, da reaktionsproduktet er let opløseligt i vand:

(virkningen af fortyndede syrer omdanner sådanne produkter til aldehyder).
Oxidation aldehyder passerer let under påvirkning af atmosfærisk ilt (produkter er de tilsvarende carboxylsyrer). Ketoner er relativt stabile over for oxidation.
Aldehyder er i stand til at deltage i reaktioner kondensation... Kondensationen af formaldehyd med phenol foregår således i to trin. I første omgang dannes et mellemprodukt, som er phenol og alkohol på samme tid:

Mellemproduktet reagerer derefter med et andet phenolmolekyle for at danne produktet polykondensation -phenol formaldehyd harpiks:

Kvalitativ reaktion til aldehydgruppen - reaktionen af "sølvspejlet", det vil sige oxidation af C (H) O -gruppen med sølv (I) oxid i nærvær af ammoniakhydrat:

Reaktionen med Cu (OH) 2 forløber på lignende måde; ved opvarmning vises et rødt bundfald af kobber (I) oxid Cu20.
Modtager: den generelle metode til aldehyder og ketoner er dehydrogenering(oxidation) af alkoholer. Med dehydrogenering primær alkoholer får aldehyder og ved dehydrogenering af sekundære alkoholer - ketoner... Normalt sker dehydrogenering ved opvarmning (300 ° C) over fint knust kobber:

Ved oxidation af primære alkoholer stærk oxidationsmidler (kaliumpermanganat, kaliumdichromat i et surt miljø), processen er vanskelig at stoppe på stadiet for opnåelse af aldehyder; aldehyder oxideres let til de tilsvarende syrer:
Et mere egnet oxidationsmiddel er kobber (II) oxid:
Acetaldehyd i industri komme ved Kucherov -reaktionen (se 19.3).
De mest anvendte aldehyder er methanal og ethanal. Methanal bruges til fremstilling af plast (fænoplast), sprængstof, lakker, maling, medicin. Ethanal- det vigtigste mellemprodukt ved syntesen af eddikesyre og butadien (produktion af syntetisk gummi). Den enkleste keton - acetone bruges som opløsningsmiddel til forskellige lakker, celluloseacetater, til fremstilling af film og sprængstoffer.
10.3. Carboxylsyrer. Estere. Fedtstoffer
Carboxylsyrer er derivater af carbonhydrider, der indeholder den funktionelle gruppe COOH ( carboxyl).
Formler og titler nogle almindelige carboxylsyrer er angivet i tabel. elleve.
Traditionelle navne på syrer НСООН ( formisk), CH3 COOH (eddike), C6H5COOH (benzoisk) og (COOH) 2 (oxalisk) det anbefales at bruge dem i stedet for deres systematiske navne.
Formler og titler syrerester er angivet i tabel. 12.
For navnene på salte af disse carboxylsyrer (såvel som deres estere, se nedenfor) bruges traditionelle navne almindeligt, for eksempel:



Lavere carboxylsyrer er farveløse væsker med en skarp lugt. Når molarmassen stiger, stiger kogepunktet.
Carboxylsyrer findes i naturen:

De enkleste carboxylsyrer er opløselige i vand, dissocieres reversibelt i en vandig opløsning med dannelsen af hydrogenkationer:
og udviser de generelle egenskaber for syrer:

Interaktionen mellem carboxylsyrer og alkoholer er af stor praktisk betydning (se nedenfor for flere detaljer):
Bemærk, at HCOOH -syre kommer ind i "sølvspejl" -reaktionen som aldehyder:
og nedbrydes under påvirkning af dehydratiserende midler:
Modtager:
Oxidation af aldehyder:
Oxidation af kulbrinter:
Desuden opnås myresyre i henhold til følgende skema:
og eddikesyre - ifølge reaktionen:
ansøge myresyre som en gyllemiddel til farvning af uld, konserveringsmiddel til frugtsaft, blegemiddel, desinfektionsmiddel. Eddikesyre bruges som råmateriale i den industrielle syntese af farvestoffer, medicin, acetatfiber, ubrændbar film, organisk glas. Natrium- og kaliumsalte af højere carboxylsyrer er hovedkomponenterne i sæbe.
Estere- produkter fra udvekslingsinteraktion mellem carboxylsyrer og alkoholer. Denne interaktion kaldes en reaktion. forestring:

Foresteringsreaktionsmekanismen blev etableret ved anvendelse af en alkohol mærket med 18 O isotopen; denne oxygen efter reaktionen optrådte i sammensætningen æter(ikke vand):
I modsætning til reaktionen af neutralisering af en uorganisk syre med en alkali (H + + OH - = H20), i esterificeringsreaktionen opgiver carboxylsyren derfor altid gruppen HAN, alkohol - atom H(vand dannes). Forestringsreaktionen er reversibel; det flyder bedre ind surt miljø, omvendt reaktion ( hydrolyse, forsæbning)- i et alkalisk miljø.
Formler og titler almindelige estere er angivet i tabel. 13.

Blandt esterne er der farveløse, lavtkogende, brandfarlige væsker med en frugtagtig lugt, for eksempel:

Estere bruges som opløsningsmidler til lakker, maling og cellulosanitrater, bærere af frugtaromaer i fødevareindustrien.
Estere af trifri alkohol - glycerol og højere carboxylsyrer (i den generelle form RCOOH), for eksempel med formler og navne:

er navngivet fed. Et eksempel på et fedtstof ville være en blandet ester af glycerol og disse syrer:

Jo højere indhold af rester af oliesyre (eller andre umættede syrer) er, desto lavere er fedtets smeltepunkt. Fedtstoffer, der er flydende ved stuetemperatur, kaldes olier. Ved hydrogenering, det vil sige tilsætning af hydrogen til dobbeltbindingen, omdannes olier til faste fedtstoffer (f.eks. Vegetabilsk olie - til margarine). Foresteringsreaktionen (fedtdannelse) er reversibel:

En direkte reaktion går bedre ind surt miljø, omvendt reaktion - hydrolyse eller forsæbning, fedt - ind alkalisk miljø; under fordøjelsen forsæbes fedt (nedbrydes) ved hjælp af enzymer.
10.4. Kulhydrater
Kulhydrater (Sahara) - de vigtigste naturlige forbindelser, der består af kulstof, brint og ilt. Kulhydrater inddeles i monosaccharider, disaccharider og polysaccharider. Monosaccharider undergår ikke hydrolyse, og resten af kulhydraterne, når de koges i nærvær af syrer, opdeles i monosaccharider.
Monosaccharider(og alle andre kulhydrater) er polyfunktionelle forbindelser. Monosaccharidmolekylet indeholder funktionelle grupper af forskellige typer: grupper HAN(alkoholfunktion) og grupper CO(aldehyd- eller ketonfunktion). Derfor skelnes aldoser(aldehydalkoholer, alkoholaldehyder) og ketose(ketonalkoholer, alkoholketoner).
Den vigtigste repræsentant for aldoser er glukose:

og en repræsentant for ketose - fructose:

Glukose (druesukker) og fructose (frugtsukker) er strukturelle isomerer, er deres molekylformel C6H12O6.
Glukose kan skelnes fra fructose på samme måde som aldehyd fra en keton - ved "sølvspejl" -reaktionen i en ammoniakopløsning af Ag20:

Esterificering af glucose og fructose (f.eks. Eddikesyre) fører til dannelse af estere for alle fem OH -grupper (erstattet af OOCH 3).
Imidlertid forekommer ikke alle reaktioner, der er karakteristiske for aldehyder, med glucose; for eksempel er der ingen additionsreaktion, der involverer natriumhydrosulfit. Årsagen er, at glukosemolekylet kan eksistere i tre isomere former, hvoraf to former (? Og?) - cyklisk... I opløsning er alle tre former i ligevægt, og den åbne (aldehyd) form, der er angivet ovenfor, er indeholdt i den mindste antal:
Cykliske former for glucose indeholder ikke en aldehydgruppe. De adskiller sig kun fra hinanden i det rumlige arrangement af H -atomet og OH -gruppen ved C1 -carbonatomet (ved siden af ilt i cyklussen):

Disaccharider dannes af to molekyler monosaccharider ved intermolekylær dehydrering. Så, saccharose(normal sukker) C 12 H 22 O 11 er et produkt af kombinationen af glukose- og fructoserester på grund af eliminering af vand:

Under hydrolyse i et surt medium omdannes saccharose igen til monosaccharider:
Den resulterende blanding er vendes sukker- indeholdt i honning. Ved 200 ° C bliver saccharose, der taber vand, til en brun masse (karamel).
Polysaccharider - stivelse og cellulose (fiber) - produkterne af henholdsvis polykondensation (intermolekylær dehydrering) af α- og β-formerne for glucose, deres generelle formel er (С 6 Н 10 О 5) n. Graden af polymerisation af stivelse er 1000–6000, og cellulose er 10.000–14.000. Cellulose er det mest udbredte organiske stof i naturen (i træ når massefraktionen af cellulose 75%). Stivelse (lettere) og cellulose (hårdere) undergår hydrolyse (betingelser: H2S04 eller HCl,> 100 ° C); slutproduktet er glukose.
Estere af cellulose med eddikesyre er af stor praktisk betydning:

De bruges til fremstilling af kunstige acetatfibre og film.
Eksempler på opgaver i del A, B1-2. For at forbinde med formlen


det korrekte navn er
1) 2-methylpropanol-2
2) 2,2-dimethylethanol
3) propylethylether
4) ethylpropylether
3-4. For at forbinde med formlen


det korrekte navn er
1) 1,1-dimethylpropansyre
2) 3-methylbutansyre
3) 2-methylpropanal
4) dimethylethanal
5. Det korrekte navn på stoffet CH 3 COOCH 2 CH 3 er
1) methylacetat
2) ethylacetat
3) methylformiat
4) ethylformiat
6. Hydrogenbindinger dannes mellem molekyler af forbindelser
3) eddikesyre
4) acetaldehyd
7. For sammensætningen C4H8O2 er navnene på strukturelle isomerer fra esterklassen
1) propylformiat
2) diethylether
3) ethylacetat
4) methylpropionat
8-11. Sammensat formel med navn
8. saccharose
9. stivelse
10. fruktose
11. fiber
svarer til sammensætningen
1) C6H12O6
2) (C6H10O5) n
3) Cl2H22O n
12. For mættede monovalente alkoholer er karakteristiske reaktioner
1) hydrolyse
2) hydrering
3) forestring
4) dehydrering
13. Molekylet i slutproduktet af reaktionen mellem phenol og brom i vand indeholder det samlede antal atomer af alle grundstoffer svarende til
14-17. I reaktionsligningen
14. oxidation af ethanol med kobber (II) oxid
15. phenolbromering
16. termolekylær dehydrering af ethanol
17. nitrering af phenol
summen af koefficienterne er
18. I forestringsreaktionen spaltes OH -gruppen fra molekylet
2) aldehyd
4) syrer
19. Ved hjælp af klorofyl i en grøn plante,
1) ilt
3) glukose
20-21. Glukosens kemiske egenskaber, karakteristisk for
20. alkoholer
21. aldehyder
manifesterer sig i reaktion
1) alkoholisk gæring
2) "sølv spejl"
3) forestring
4) neutralisering
22-24. Ved opvarmning med vand i nærvær af H2S04 -kulhydrater
22. stivelse
23. cellulose
24. saccharose
efter afslutningen af hydrolyse få
2) fructose
3) gluconinsyre
4) glukose
25. Metoder til fremstilling af ethanol er
1) hydrering af eten
2) gæring af glukose
3) genvinding af ethanal
4) oxidation af ethanal
26. Metoder til fremstilling af ethylenglycol er
1) oxidation af eten
2) hydrering af eten
3) virkningen af alkali på 1,2-C2H4CI2
4) hydrering af ethin
27. Metoder til opnåelse af myresyre er
1) metanoxidation
2) oxidation af phenol
3) oxidation af methanol
4) reaktionen af CH30H med CO
28. Til syntese af eddikesyre anvendes forbindelser
1) C2H5OH
29. Metanol bruges i produktionen
1) plast
2) gummi
3) benzin
4) fedtstoffer og olier
30. For at genkende phenol (blandet med 1-butanol) brug
1) indikator og alkaliløsning
2) bromvand
3) kobber (II) hydroxid
4) ammoniakopløsning af sølvoxid (I)
31. Det samme reagens er egnet til genkendelse af glycerin, eddikesyre, acetaldehyd og glucose i deres opløsninger
3) H 2 SO 4 (konc.)
4) Ag20 (i opløsning NH 3)
32. Organisk stof - et produkt af acetylenhydrering, som kommer ind i en "sølvspejl" -reaktion, og efter reduktion danner ethanol, er
1) acetaldehyd
2) eddikesyre
33. Produkter A, B og C i reaktionsskemaet CO 2 + H 2 O> fotosyntese A> fermentering - CO 2 B> HCOOH B
- dette er i overensstemmelse hermed
2) glukose
3) propansyre
4) ethylformiat
34. Phenol deltager i processerne:
1) dehydrering
2) bromering
3) isomerisering
4) neutralisering
5) nitrering
6) "sølv spejl"
35. Reaktionsforløbet er muligt:
1) fast fedt + brint> ...
2) myresyre + formaldehyd> ...
3) methanol + kobber (II) oxid> ...
4) saccharose + vand (i konc. H 2 SO 4)> ...
5) methanal + Ag20 (i opløsning NH 3)> ...
6) ethylenglycol + NaOH (opløsning)> ...
36. Til industriel syntese af phenol-formaldehydharpiks skal du tage et sæt reagenser
1) C6H6, HC (H) O
2) C6H6, CH3C (H) O
3) C6H5OH, HC (H) O
4) C6H5OH, CH3C (H) O
Mål. At kende en stor gruppe af organiske stoffer, der er genetisk relaterede til hinanden (struktur, isomerisme, nomenklatur, fysiske egenskaber, klassificering); at danne en generel idé om alkoholer, aldehyder, carboxylsyrer; fortsætte udviklingen af generelle uddannelsesmæssige færdigheder; at uddanne behovet for viden om de stoffer, som vi kommer i kontakt med i dagligdagen - de findes i fødevarer, medicin.
Demonstrationsmateriale. Indsamling af carboxylsyrer, alkoholer, phenol, formalin.
Demonstrationsforsøg. Undersøgelse af alkoholers opløselighed i vand (ethanol,n-propanol og n -butanol), syrer (myresyre, eddikesyre, propionsyre, smørsyre, stearinsyre og palmitinsyre), aldehyder (40% myret aldehydopløsning - formalin).
Visuel support. Tabeller "Dannelse af hydrogenbindinger", "Alkoholer og aldehyder"; molekylære modeller; billeder med formlerne for de mest almindelige syrer.
Uddel. Informationskort til lektionen.
Intersubject og intrasubject kommunikation. Uorganisk kemi: mineralsyrer, hydrogenbindinger mellem molekyler; organisk kemi: kulbrinter (generelle formler, struktur, nomenklatur, isomerisme); matematik: funktion; fysik: stoffers fysiske egenskaber, konstanter.
UNDER KLASSENE
Eksempler: myresyre, oxalsyre, citronsyre, æblesyre, mælkesyre, "vinalkohol" (ethanol), formalin (40% opløsning af myret aldehyd i vand), glycerin, acetone, æter til anæstesi (diethylether), phenol.
Øvelse 1. Opdel følgende stoffer i tre grupper - alkoholer, aldehyder, carboxylsyrer:

Opgave 2. Hvad er kriterierne for klassificering af oxygenholdige forbindelser? Hvad er de funktionelle grupper af alkoholer, aldehyder og carboxylsyrer?
Funktionelle grupper af stoffer af forskellige klasser
AlkoholerAldehyder
Carboxylsyrer
HAN
hydroxyl
Opgave 3. Hvad er navnet på kulbrintefragmentet i formlerne af organiske oxygenholdige forbindelser? For eksempel i opgave 1 (se ovenfor) er disse fragmenter: CH3, C4H9, C5H11, C2H5, C7H15, C3H7.
Ved at betegne carbonhydridradikalen med bogstavet R får vi de generelle formler:
alkoholer - ………………………. ;
aldehyder - ……………… ..;
organiske syrer - …………………. ...
Klassificeringen af alkoholer, aldehyder og syrer kan udføresefter antallet af funktionelle grupper i molekyler. Skel mellem mono-, di- og trihydric alkoholer:

Aldehyder med to CHO -aldehydgrupper i molekylet kaldes som følger:

Carboxylsyrer, afhængigt af antallet af carboxylgrupper i molekylet, er mono-, di- og tri-basiske:

Oxygenerede forbindelser variererved strukturen af carbonhydridradikalen. De er begrænsende (mættede), umættede (umættede), cykliske, aromatiske.
Eksempler på alkoholer:

Eksempler på aldehyder:

Eksempler på carboxylsyrer:

Vi vil kun undersøge mættede monobasiske carboxylsyrer, monovalente alkoholer og aldehyder.
Opgave 4. Giv definitionen på mættede alkoholer, aldehyder, carboxylsyrer.
Alkoholer er primære, sekundære og tertiære. I primære alkoholer, ved C -atomet bundet til OH -hydroxylgruppen, er der én carbon -nabo; i sekundære alkoholer ved C -atomet er der sammen med OH -gruppen to carbon -substituenter (naboer), og i tertiære alkoholer er der tre carbon -substituenter. For eksempel:

Nomenklatur
iltede forbindelser
Ifølge IUPAC's internationale nomenklatur stammer alkoholernes navne fra navnene på de tilsvarende alkaner med tilføjelsen af suffikset "ol".
Opgave 5. Skriv ned molekylformlerne og navnene på fire primære alkoholer med 4 eller flere carbonatomer.Det særlige ved navne på aldehyder er suffikset "al".
Opgave 6. Indtast IUPAC -formlerne og navnene på de følgende fire aldehyder i tabellen.
Opgave 7. Skriv IUPAC -formlerne og navnene for de følgende fire syrer ned i tabellen.
Opgave 8. Hvorfor kan methanal og methansyre ikke betragtes som homologer? Hvordan adskiller de sig fra homologer?
Fysiske egenskaber.
Hydrogenbinding
1) Aggregeret tilstand af lineære forbindelser af forskellige klasser.
Opgave 9. Hvorfor er der så mange gasser blandt alkaner? Hvorfor findes der gasformigt aldehyd under normale forhold (0 ° C, 1 atm)? Med hvad kan det forbindes?2) Skumtemperatur (° C) for de første fem homologer af stoffer i fire klasser.
Opgave 10. Sammenlign kogepunkterne for de tilsvarende (med antallet af C -atomer) alkaner, alkoholer, aldehyder og carboxylsyrer. Hvad er egenskaberne ved denne egenskab for stoffer fra forskellige homologe serier?3) En hydrogenbinding i rækken af forbindelser, der overvejes, er en intermolekylær binding mellem oxygenet i et molekyle og hydroxylhydrogenet i et andet molekyle.
Referenceinformation - elektronegativitet af atomer: C - 2,5; H - 2,1; Omkring - 3.5.
Fordelingen af elektrontæthed i molekyler af alkoholer og carboxylsyrer er ujævn:

Hydrogenbindingen i alkoholer og syrer er afbildet som følger:

Konklusion: I den homologe serie af alkoholer og carboxylsyrer mangler gasformige stoffer, og stoffernes kogepunkter er høje. Dette skyldes tilstedeværelsen af hydrogenbindinger mellem molekyler. På grund af hydrogenbindinger viser molekylerne sig at være associerede (som om de er tværbundet), for at molekylerne skal blive frie og blive flygtige, er det derfor nødvendigt at bruge ekstra energi på at bryde disse bindinger.
4) Opløseligheden i vand demonstreres eksperimentelt ved eksemplet med opløseligheden i vand af alkoholer - ethyl, propyl, butyl og syrer - myresyre, eddikesyre, propionsyre, smørsyre og stearinsyre. En opløsning af myret aldehyd i vand påvises også.
Opgave 11. Hvad kan man sige om opløseligheden af alkoholer, aldehyder og carboxylsyrer i vand? Hvad forklarer opløseligheden af disse stoffer?
Når du svarer, skal du bruge skemaet til dannelse af hydrogenbindinger mellem syre- og vandmolekyler:

Det skal bemærkes, at med en stigning i molekylvægt falder vandopløseligheden af alkoholer og syrer. Jo mere kulbrinteradikal i alkohol- eller syremolekylet, desto vanskeligere er det for OH -gruppen at holde molekylet i opløsning på grund af dannelsen af svage hydrogenbindinger.
Strukturen af alkoholer, aldehyder,
carboxylsyrer
Opgave 12.
Lav et lignende bord derhjemme for de andet medlemmer af den homologe serie af alkoholer, aldehyder og carboxylsyrer.
Isomer af alkoholer, aldehyder
og carboxylsyrer
1) Målinger med pyrt på eksemplet med pentanol C 5 H 11 OH (viser isomers kulkæder):

Opgave 13. Ved kulstofkæder navngiv de forgrenede isomerer af alkoholer med sammensætningen C 5 H 11 OH:

Opgave 14. Er disse stoffer isomerer:

Opgave 15. Hvilke typer isomerisme er typiske for alkoholer?
2) SIZE ME R iAl DEGIDOV på eksempletn -pentanal eller baldrianaldehydn-С 4 Н 9 СНО:

Opgave 16. Hvilke typer isomerisme er karakteristiske for aldehyder?
3) Målinger af en carbone slot på eksempletn -pentansyre eller valerinsyren-C 4 H 9 COOH:

Opgave 17. Hvilke typer isomerisme er karakteristiske for carboxylsyrer?
Opgave 18. Skriv strukturformlerne for følgende stoffer ned:
a) 2,4-dimethyl-3-ethylhexanal;
b) 2,2,4-trimethyl-3-isopropylpentanal;
c) 2,3,4-trimethyl-3-ethylpentandiol-1,2;
d) 2,3,4-trimethyl-3-isopropylhexantetriol-1,2,4;
e) 3,4,5,5-tetramethyl-3,4-diethylheptansyre;
f) 2,4-dimethylhexen-3-oinsyre.
Lektier
Lær de trivielle navne på de første fem aldehyder og carboxylsyrer.
Udfyld tabellen "Struktur af alkoholer, aldehyder, carboxylsyrer" for de andre medlemmer af disse homologe serier (se opgave 12).
Skriv alle mulige isomerer for butanol C 4 H 10 O, butanal C 4 H 8 O og butansyre C 4 H 8 O 2 , kalder dem IUPAC.
At løse opgaven. En af de polyvalente alkoholer bruges til fremstilling af frostvæske - væsker, der fryser ved lave temperaturer. Frostvæsker bruges i vinterforhold til at afkøle bilmotorer. Find molekylformlen for denne alkohol, hvis massefraktionen af kulstof i den er 38,7%, brint - 9,7%, ilt - 51,6%. Den relative tæthed af dets dampe til brint er 31. Skriv strukturformlen for alkohol, og navngiv den.