Скоростта на химичните реакции може да се увеличи драстично в присъствието на различни вещества, които не са реагенти и не са част от реакционните продукти. Това забележително явление се нарича катализа(от гръцки "катализа" - разрушаване). Вещество, което увеличава скоростта на реакция в смес, се нарича катализатор.Количеството му преди и след реакцията остава непроменено. Катализаторите не представляват специален клас вещества. При различни реакции метали, оксиди, киселини, соли и комплексни съединения могат да проявят каталитичен ефект. Химическите реакции в живите клетки протичат под контрола на каталитични протеини, наречени ензими.Катализата трябва да се разглежда като истински химичен фактор за увеличаване на скоростта на химичните реакции, тъй като катализаторът участва пряко в реакцията. Катализата често е по-мощна и по-малко рискова за ускоряване на реакцията, отколкото повишаването на температурата. Това ясно се проявява на примера на химичните реакции в живите организми. Реакциите, като хидролизата на протеини, която в лабораториите трябва да се извършва при продължително нагряване до точката на кипене, по време на храносмилането протичат без нагряване при телесна температура.
За първи път явлението катализа е наблюдавано от френския химик Л. Ж. Тенар (1777-1857) през 1818 г. Той открива, че оксидите на някои метали, когато се добави водороден прекис към разтвор, предизвикват неговото разлагане. Такъв опит е лесно да се възпроизведе чрез добавяне на кристали калиев перманганат към 3% разтвор на водороден прекис. Солта KMp0 4 се превръща в Mn0 2 и кислородът бързо се освобождава от разтвора под действието на оксид:
Директният ефект на катализатора върху скоростта на реакцията е свързан с намаляване на енергията на активиране. При нормално понижение на температурата? и с 20 kJ/mol увеличава скоростната константа приблизително 3000 пъти. понижаване Е Лможе да е много по-силен. Намаляването на енергията на активиране обаче е външна проява на действието на катализатора. Реакцията се характеризира с определена стойност E. vкоето може да се промени само ако се промени самата реакция. При даването на едни и същи продукти реакцията с участието на добавеното вещество протича по различен път, през различни етапи и с различна енергия на активиране. Ако по този нов път енергията на активиране е по-ниска и реакцията е съответно по-бърза, тогава казваме, че това вещество е катализатор.
Катализаторът взаимодейства с един от реагентите, образувайки някакво междинно съединение. На един от следващите етапи на реакцията катализаторът се регенерира - той напуска реакцията в първоначалния й вид. Реагентите, участващи в каталитична реакция, продължават да взаимодействат помежду си и по бавен път без участието на катализатор. Следователно, каталитичните реакции принадлежат към различни сложни реакции, наречени последователно-паралелни. На фиг. 11.8 показва зависимостта на константата на скоростта от концентрацията на катализатора. Графиката на зависимостта не преминава през нула, тъй като при липса на катализатор реакцията не спира.

Ориз. 11.8.
наблюдаема константа кизразено като сума k u+ & k c(k)
Пример 11.5. При температура от -500 °C реакцията на окисление на серен оксид (IV)
което е един от етапите на промишленото производство на сярна киселина, е много бавно. По-нататъшно повишаване на температурата е неприемливо, тъй като равновесието се измества наляво (екзотермична реакция) и добивът на продукта пада твърде много. Но тази реакция се ускорява от различни катализатори, един от които може да бъде азотен оксид (II). Първо, катализаторът реагира с кислород: ![]()
и след това прехвърля кислороден атом към серен оксид (IV):
Така се образува крайният продукт от реакцията и катализаторът се регенерира. За реакцията беше отворена възможността за протичане по нов път, в който скоростните константи се увеличиха значително:

Диаграмата по-долу показва и двата пътя на процеса на окисление на S0 2. При липса на катализатор реакцията протича само по бавен път, а при наличие на катализатор и по двете.
Има два вида катализа - хомогеннаи хетерогенен.В първия случай катализаторът и реагентите образуват хомогенна система под формата на газова смес или разтвор. Пример за окисление на серен оксид е хомогенната катализа. Скоростта на хомогенна каталитична реакция зависи както от концентрациите на реагентите, така и от концентрацията на катализатора.
При хетерогенна катализа катализаторът е твърдо вещество в чиста форма или на подложка носител.Например, платината като катализатор може да бъде фиксирана върху азбест, алуминиев оксид и др. Молекулите на реагента се адсорбират (абсорбират) от газ или разтвор в определени точки на повърхността на катализатора – активни центрове и се активират едновременно. След химическата трансформация, получените молекули на продукта се десорбират от повърхността на катализатора. Актовете на трансформация на частиците се повтарят в активните центрове. Наред с други фактори, скоростта на хетерогенна каталитична реакция зависи от повърхността на каталитичния материал.
Хетерогенната катализа е особено широко използвана в промишлеността. Това се дължи на лекотата на провеждане на непрекъснат каталитичен процес с преминаване на смес от реагенти през контактен апарат с катализатор.
Катализаторите действат селективно, ускорявайки много специфичен тип реакция или дори една реакция, без да засягат други. Това прави възможно използването на катализатори не само за ускоряване на реакциите, но и за целенасочено превръщане на изходните материали в желаните продукти. Метанът и водата при 450 ° C на Fe 2 0 3 катализатора се превръщат във въглероден диоксид и водород:
Същите вещества при 850 °C реагират върху повърхността на никела, за да образуват въглероден оксид (II) и водород:

Катализата принадлежи към онези области на химията, в които все още не е възможно да се правят точни теоретични прогнози. Всички промишлени катализатори за преработка на петролни продукти, природен газ, производство на амоняк и много други са разработени на базата на трудоемки и продължителни експериментални изследвания.
Способността да се контролира скоростта на химичните процеси е от неоценимо значение в човешката икономическа дейност. При промишленото производство на химически продукти обикновено е необходимо да се увеличат скоростите на технологичните химични процеси, а при съхранението на продуктите се изисква намаляване на скоростта на разлагане или излагане на кислород, вода и др. Известни вещества, които могат да забавят химичните реакции. Те се наричат инхибитори, или отрицателни катализатори.Инхибиторите са коренно различни от истинските катализатори по това, че реагират с активни видове (свободни радикали), които по една или друга причина възникват в дадено вещество или неговата среда и предизвикват ценни реакции на разлагане и окисляване. Инхибиторите постепенно се консумират, прекратявайки тяхното защитно действие. Най-важният вид инхибитори са антиоксидантите, които предпазват различни материали от въздействието на кислорода.
Трябва също да се напомни какво не може да се постигне с помощта на катализатори. Те са способни да ускоряват само спонтанните реакции. Ако реакцията не протича спонтанно, тогава катализаторът няма да може да я ускори. Например, нито един катализатор не може да причини разлагане на водата до водород и кислород. Този процес може да се извърши само чрез електролиза, като се извършва електрическа работа.
Катализаторите също могат да активират нежелани процеси. През последните десетилетия се наблюдава постепенно разрушаване на озоновия слой на атмосферата на височина 20-25 км. Предполага се, че някои вещества участват в разпадането на озона, например халогенирани въглеводороди, отделяни в атмосферата от промишлени предприятия, както и използвани за битови цели.
Катамлис-селективно ускоряване на една от възможните термодинамично разрешени направления на химическа реакция под действието на катализатор(и), който многократно влиза в междинно химично взаимодействие с участниците в реакцията и възстановява химичния си състав след всеки цикъл на междинни химични взаимодействия. Терминът "катализа" е въведен през 1835 г. от шведския учен Йонс Якоб Берцелиус.
Явлението катализа е широко разпространено в природата (повечето от процесите, протичащи в живите организми, са каталитични) и се използва широко в технологиите (в нефтопреработката и нефтохимията, при производството на сярна киселина, амоняк, азотна киселина и др.). Повечето от всички промишлени реакции са каталитични.
КатализаториВеществата, които променят скоростта на химичните реакции, се наричат.
Някои катализатори значително ускоряват реакцията - положителна катализа, или просто катализа, други забавят - отрицателна катализа. Примери за положителна катализа са производството на сярна киселина, окисляването на амоняка до азотна киселина с помощта на платинен катализатор и др.
Според влиянието върху скоростта на реакцията, катализата се разделя на положителна (скоростта на реакцията се увеличава) и отрицателна (скоростта на реакцията намалява). В последния случай се осъществява процес на инхибиране, който не може да се счита за "отрицателна катализа", тъй като инхибиторът се консумира по време на реакцията.
Катализата може да бъде хомогенна и хетерогенна (контактна). При хомогенна катализа катализаторът е в същата фаза като реагентите, докато хетерогенните катализатори се различават по фаза.
хомогенна катализа.
Примерхомогенната катализа е разлагането на водороден пероксид в присъствието на йодни йони. Реакцията протича на два етапа:
H2 O2+I> H2O+IO, H2O2+io> H2O + O2+ аз
При хомогенна катализа действието на катализатора се дължи на факта, че той взаимодейства с реагентите за образуване на междинни съединения, което води до намаляване на енергията на активиране.
хетерогенна катализа.
При хетерогенната катализа ускоряването на процеса обикновено се случва на повърхността на твърдо тяло - катализатора, така че активността на катализатора зависи от размера и свойствата на неговата повърхност. На практика катализаторът обикновено се поддържа върху твърда пореста подложка.
Механизмът на хетерогенната катализа е по-сложен от този на хомогенната катализа. Механизмът на хетерогенната катализа включва пет етапа, всички от които са обратими.
- 1. Дифузия на реагентите към повърхността на твърдо вещество
- 2. Физическа адсорбция върху активните места на повърхността на твърдо вещество от реагиращи молекули и след това тяхната хемосорбция
- 3. Химическа реакция между реагиращи молекули
- 4. Десорбция на продукти от повърхността на катализатора
- 5. Дифузия на продукта от повърхността на катализатора в общия поток
Пример за хетерогенна катализа е окисляването на SO 2 до SO 3 върху V 2 O 5 катализатор при производството на сярна киселина (контактен метод).
Повечето каталитични реакции се извършват върху порести катализатори, чиято вътрешна повърхност се състои от пори и канали с различни размери и дължини. Тези пори могат да бъдат изолирани или свързани една с друга. Основният фактор, определящ скоростта и естеството на движението на газовете в порите на катализатора, е размерът на порите. Скоростта на свободното движение на молекулите може да достигне 1000 m/s, а забавянето на движението в порите е свързано със сблъсъци между газовите молекули и стените на порите.
Повечето каталитични реакции са неселективни, което налага известни ограничения на кинетичните методи за анализ.
Повечето каталитични реакции включват няколко различни типа атоми и молекули. Определянето на механизма на реакцията и естеството на силите, действащи между тези атоми и молекули и между тях и повърхността, разбира се, е трудна задача, но може да бъде опростена чрез изследване на адсорбционното поведение на един тип атоми или молекули . Такива изследвания показват, че когато определени молекули се адсорбират върху определени адсорбенти, връзката в молекулата се прекъсва и се появяват две връзки с адсорбента; в този случай адсорбираната молекула се трансформира в два адсорбирани атома. Този процес е повърхностна химическа реакция и образуваните адсорбирани атоми се наричат хемосорбирани атоми. Ако такава реакция не протича при достатъчно ниски температури и адсорбираните молекули не се разлагат на два адсорбирани атома, тогава такива молекули се наричат физически адсорбирани.
ускоряване на химичните реакции под действието на малки количества вещества (катализатори), които сами по себе си не се променят по време на реакцията. Каталитичните процеси играят огромна роля в нашия живот. Биологични катализатори, наречени ензими, участват в регулирането на биохимичните процеси. Много промишлени процеси не биха били възможни без катализатори.Най-важното свойство на катализаторите е селективността, т.е. способността да се увеличава скоростта само на определени химични реакции от многото възможни. Това позволява реакциите, които са твърде бавни при нормални условия, да бъдат от практическа полза и осигурява образуването на желаните продукти.
Използването на катализатори допринесе за бързото развитие на химическата промишленост. Те се използват широко при рафинирането на нефт, получаването на различни продукти, създаването на нови материали (например пластмаси), често по-евтини от използваните преди. Приблизително 90% от съвременното химическо производство се основава на каталитични процеси. Каталитичните процеси играят специална роля в опазването на околната среда.
През 1835 г. шведският химик Й. Берцелиус открива, че в присъствието на определени вещества скоростта на определени химични реакции се увеличава значително. За такива вещества той въвежда термина "катализатор" (от гръцки.
катализа- релаксация). Според Берцелиус катализаторите имат специална способност да отслабват връзките между атомите в молекулите, участващи в реакцията, като по този начин улесняват тяхното взаимодействие. Голям принос за развитието на идеите за работата на катализаторите има немският физикохимик В. Оствалд, който през 1880 г. определя катализатора като вещество, което променя скоростта на реакцията.Според съвременните концепции катализаторът образува комплекс с реагиращи молекули, който се стабилизира чрез химични връзки. След пренареждане този комплекс се дисоциира, за да освободи продукти и катализатор. За мономолекулна реакция на трансформация на молекула
X до Y Целият процес може да бъде представен като X + Кат. ® X -Кат. ® Y -Кат. ® Y + Кат. Освободеният катализатор се свързва отново сх , а целият цикъл се повтаря многократно, осигурявайки образуването на големи количества от продукта – вещество Y . Много вещества при нормални условия не влизат в химична реакция помежду си. Така че, водородът и въглеродният оксид при стайна температура не взаимодействат един с друг, тъй като връзката между атомите в молекулата H2 достатъчно здрав и не се счупва при атака от молекула CO . Катализаторът обединява молекулите H2 и CO като създават връзки с тях. След пренареждане, комплексът катализатор-реагент се дисоциира, за да образува продукт, съдържащ атомиС, Н и О. Често при взаимодействие на едни и същи вещества се образуват различни продукти. Катализаторът може да насочи процеса по най-благоприятния път за образуване на конкретен продукт. Помислете за реакцията между CO и H2 . В присъствието на катализатор, съдържащ мед, метанолът е практически единственият реакционен продукт:Първоначално молекулите на CO и H 2 адсорбиран върху повърхността на катализатора. Тогава молекулите на CO образуват химически връзки с катализатора (настъпва хемосорбция), оставайки в недисоциирана форма. Молекулите на водорода също се хемосорбират върху повърхността на катализатора, но в същото време се дисоциират. В резултат на пренареждането преходният комплекс H-Cat.- CH2OH . След добавяне на атомХ комплексът се разпада, за да се освободи CH3OH и катализатор. В присъствието на никелов катализатор, CO и H 2 се хемосорбират на повърхността в дисоциирана форма и се образува комплексът Cat.-CH 3 . Крайните продукти на реакцията са СН 4 и H 2 O: Повечето каталитични реакции се провеждат при определени налягания и температури чрез преминаване на реакционната смес, която е в газообразно или течно състояние, през реактор, пълен с катализаторни частици. Следните понятия се използват за описание на реакционните условия и характеризиране на продуктите. Пространствена скорост - обемът на газа или течността, преминаващ през единица обем на катализатора за единица време. Каталитична активност - количеството реагенти, превърнати от катализатора в продукти за единица време. Превръщането е пропорцията на веществото, превърнато в дадена реакция. Селективността е съотношението на количеството на определен продукт към общото количество продукти (обикновено изразено като процент). Добив - съотношението на количеството на даден продукт към количеството изходен материал (обикновено изразено като процент). Производителност - количеството реакционни продукти, образувани на единица обем за единица време. ВИДОВЕ КАТАЛИЗАТОРИ
Катализаторите се класифицират според естеството на реакцията, която насърчават, техния химичен състав или физическите им свойства. Почти всички химични елементи и вещества имат каталитични свойства в една или друга степен - сами по себе си или по-често в различни комбинации. Според физическите си свойства катализаторите се делят на хомогенни и хетерогенни. Хетерогенните катализатори са твърди вещества, които са хомогенни и диспергирани в същата газообразна или течна среда като реагентите.
Повечето каталитични реакции се провеждат при определени налягания и температури чрез преминаване на реакционната смес, която е в газообразно или течно състояние, през реактор, пълен с катализаторни частици. Следните понятия се използват за описание на реакционните условия и характеризиране на продуктите. Пространствена скорост - обемът на газа или течността, преминаващ през единица обем на катализатора за единица време. Каталитична активност - количеството реагенти, превърнати от катализатора в продукти за единица време. Превръщането е пропорцията на веществото, превърнато в дадена реакция. Селективността е съотношението на количеството на определен продукт към общото количество продукти (обикновено изразено като процент). Добив - съотношението на количеството на даден продукт към количеството изходен материал (обикновено изразено като процент). Производителност - количеството реакционни продукти, образувани на единица обем за единица време. ВИДОВЕ КАТАЛИЗАТОРИ
Катализаторите се класифицират според естеството на реакцията, която насърчават, техния химичен състав или физическите им свойства. Почти всички химични елементи и вещества имат каталитични свойства в една или друга степен - сами по себе си или по-често в различни комбинации. Според физическите си свойства катализаторите се делят на хомогенни и хетерогенни. Хетерогенните катализатори са твърди вещества, които са хомогенни и диспергирани в същата газообразна или течна среда като реагентите. Много хетерогенни катализатори съдържат метали. Някои метали, особено тези, свързани с
VIII група от периодичната система от елементи, които сами по себе си имат каталитична активност; типичен пример е платината. Но повечето метали проявяват каталитични свойства, като са в състава на съединенията; пример - алуминиев оксид (алуминиев оксид Al2O3). Необичайно свойство на много хетерогенни катализатори е тяхната голяма повърхност. Те са пронизани от множество пори, чиято обща площ понякога достига 500 m 2 на 1 g катализатор. В много случаи оксидите с голяма повърхност служат като субстрат, върху който се отлагат частици от метален катализатор под формата на малки клъстери. Това осигурява ефективно взаимодействие на реагентите в газовата или течната фаза с каталитично активния метал. Специален клас хетерогенни катализатори са зеолитите - кристални минерали от групата на алумосиликатите (съединения на силиций и алуминий). Въпреки че много хетерогенни катализатори имат голяма повърхност, те обикновено имат само малък брой активни места, които представляват малка част от общата повърхност. Катализаторите могат да загубят своята активност в присъствието на малки количества химични съединения, наречени катализаторни отрови. Тези вещества се свързват с активните центрове, блокирайки ги. Определянето на структурата на активните центрове е обект на интензивни изследвания.Хомогенните катализатори имат различна химическа природа - киселини (H
2SO4 или H3RO4), основи (NaOH ), органични амини, метали, най-често преходни ( Fe или Rh ), под формата на соли, органометални съединения или карбонили. Към катализаторите се включват и ензими - протеинови молекули, които регулират биохимичните реакции. Активното място на някои ензими съдържа метален атом ( Zn, Cu, Fe или Mo). Съдържащите метал ензими катализират реакции, включващи малки молекули ( O 2 , CO 2 или N 2 ). Ензимите имат много висока активност и селективност, но работят само при определени условия, като тези, при които реакциите протичат в живите организми. Индустрията често използва т.нар. имобилизирани ензими. КАК ДЕЙСТВАТ КАТАЛИЗАТОРИТЕ Енергия. Всяка химическа реакция може да протече само ако реагентите преодолеят енергийната бариера и за това те трябва да придобият определена енергия. Както вече казахме, каталитичната реакция X ® Y се състои от поредица от последователни етапи. Всеки се нуждае от енергия, за да работи.Е наречена енергия на активиране. Промяната в енергията по координатата на реакцията е показана на фиг. един.Помислете първо за некаталитичния, "термичен" път. За да се осъществи реакцията, потенциалната енергия на молекулите
х трябва да надвишава енергийната бариераЕт . Каталитичната реакция се състои от три етапа. Първият е образуването на комплекса X-Cat. (хемосорбция), енергията на активиране на която еЕреклами . Вторият етап е пренареждането на X-Cat.®Y -Котка. с активираща енергияЕкотка , и накрая, третият - десорбция с енергия на активиранеЕ des; Ереклами, Екат и Ее много по-малък Ет . Тъй като скоростта на реакцията зависи експоненциално от енергията на активиране, каталитичната реакция протича много по-бързо от термичната при дадена температура.Катализаторът може да бъде оприличен на инструктор-водач, който насочва катерачи (реагиращи молекули) през планинска верига. Той води една група през прохода и след това се връща за следващата. Пътят през прохода лежи много по-ниско от този, който лежи през върха (термичният канал на реакцията), а групата прави прехода по-бързо, отколкото без проводник (катализатор). Възможно е дори самостоятелно групата да не е успяла да преодолее билото.
Теории на катализа. Предложени са три групи теории за обяснение на механизма на каталитичните реакции: геометрични, електронни и химични. В геометричните теории основното внимание се обръща на съответствието между геометричната конфигурация на атомите на активните центрове на катализатора и атомите на тази част от реагиращите молекули, която е отговорна за свързването с катализатора. Електронните теории се основават на идеята, че хемосорбцията се дължи на електронно взаимодействие, свързано с пренос на заряд, т.е. тези теории свързват каталитичната активност с електронните свойства на катализатора. Химическата теория разглежда катализатора като химично съединение с характерни свойства, което образува химични връзки с реагентите, което води до образуването на нестабилен преходен комплекс. След разлагането на комплекса с освобождаването на продуктите, катализаторът се връща в първоначалното си състояние. Последната теория сега се счита за най-адекватна.На молекулярно ниво реакцията на каталитична газова фаза може да бъде представена по следния начин. Едната реагираща молекула се свързва с активното място на катализатора, докато другата взаимодейства с него, докато е директно в газовата фаза. Възможен е и алтернативен механизъм: реагиращите молекули се адсорбират върху съседни активни места на катализатора и след това взаимодействат една с друга. Очевидно така протичат повечето каталитични реакции.
Друга концепция предполага, че има връзка между пространственото подреждане на атомите върху повърхността на катализатора и неговата каталитична активност. Скоростта на някои каталитични процеси, включително много реакции на хидрогениране, не зависи от взаимното подреждане на каталитично активните атоми на повърхността; скоростта на другите, напротив, се променя значително с промяна в пространствената конфигурация на повърхностните атоми. Пример е изомеризацията на неопентан до изопентан и едновременното крекиране на последния до изобутан и метан върху повърхността на катализатора.
Pt-Al 2 O 3 . ПРИЛОЖЕНИЕ НА КАТАЛИЗАТА В ПРОМИШЛЕНОСТТА Бързият индустриален растеж, който наблюдаваме сега, не би бил възможен без развитието на нови химически технологии. До голяма степен този напредък се определя от широкото използване на катализатори, с помощта на които нискокачествените суровини се превръщат в продукти с висока стойност. Образно казано, катализаторът е философският камък на съвременния алхимик, само че той не превръща оловото в злато, а суровините в лекарства, пластмаси, химикали, гориво, торове и други полезни продукти.Може би първият каталитичен процес, който човекът се научи да използва, е ферментацията. Рецепти за приготвяне на алкохолни напитки са били известни на шумерите още през 3500 г. пр.н.е.
См. ВИНО; БИРА.Значителен крайъгълен камък в практическото приложение на катализата е производството на маргарин чрез каталитично хидрогениране на растително масло. За първи път тази реакция в индустриален мащаб е извършена около 1900 г. А от 20-те години на миналия век каталитични методи са разработени един след друг за производството на нови органични материали, предимно пластмаси. Ключовият момент беше каталитичното производство на олефини, нитрили, естери, киселини и др. - "тухли" за химическо "строителство" на пластмаси.
Третата вълна на промишлено използване на каталитични процеси настъпва през 30-те години на миналия век и е свързана с рафинирането на нефт. По отношение на обема, тази продукция скоро изостави всички останали. Рафинирането на нефт се състои от няколко каталитични процеса: крекинг, реформинг, хидросулфониране, хидрокрекинг, изомеризация, полимеризация и алкилиране.
И накрая, четвъртата вълна в използването на катализа е свързана с опазването на околната среда. Най-известното постижение в тази област е създаването на каталитичен конвертор за автомобилни изгорели газове. Катализаторите, които се монтират в автомобилите от 1975 г., изиграха голяма роля за подобряване на качеството на въздуха и по този начин спасиха много животи.
Присъдени са около дузина Нобелови награди за работа в областта на катализата и свързаните с нея области.
Практическото значение на каталитичните процеси се доказва от факта, че делът на азота, който е част от азотсъдържащите съединения, получени индустриално, представлява около половината от целия азот, който е част от хранителните продукти. Количеството на азотните съединения, произведени естествено, е ограничено, така че производството на диетичен протеин зависи от количеството азот, внесен в почвата с торове. Би било невъзможно да се нахрани дори половината от човечеството без синтетичен амоняк, който се произвежда почти изключително чрез каталитичния процес на Хабер-Бош.
Обхватът на катализаторите непрекъснато се разширява. Също така е важно, че катализата може значително да повиши ефективността на предварително разработените технологии. Пример е подобряването на каталитичния крекинг чрез използването на зеолити.
Хидрогениране. Голям брой каталитични реакции са свързани с активирането на водороден атом и друга молекула, което води до тяхното химично взаимодействие. Този процес се нарича хидрогениране и лежи в основата на много етапи от рафинирането на нефт и производството на течни горива от въглища (процесът на Бергиус).Производството на авиационен бензин и моторно гориво от въглища е развито в Германия по време на Втората световна война, тъй като в тази страна няма нефтени находища. Процесът на Бергиус е директно добавяне на водород към въглерод. Въглищата се нагряват под налягане в присъствието на водород и се получава течен продукт, който след това се преработва в авиационен бензин и моторно гориво. Като катализатор се използва железен оксид, както и катализатори на базата на калай и молибден. По време на войната приблизително 1400 тона течно гориво на ден са получени в 12 германски фабрики по метода на Бергиус.
Друг процес, Фишер - Тропш, се състои от два етапа. Първо въглищата се газифицират, т.е. осъществява своята реакция с водна пара и кислород и получава смес от водород и въглеродни оксиди. Тази смес се превръща в течно гориво с помощта на катализатори, съдържащи желязо или кобалт. С края на войната производството на синтетично гориво от въглища в Германия е преустановено.
В резултат на покачването на цените на петрола, което последва петролното ембарго през 1973-1974 г., бяха положени енергични усилия за разработване на икономически жизнеспособен метод за производство на бензин от въглища. По този начин, директното втечняване на въглища може да се извърши по-ефективно, като се използва двуетапен процес, при който въглищата първо влизат в контакт с алуминиево-кобалт-молибденов катализатор при относително ниска и след това при по-висока температура. Цената на такъв синтетичен бензин е по-висока от тази, получена от нефт.
амоняк. Един от най-простите процеси на хидрогениране от химическа гледна точка е синтезът на амоняк от водород и азот. Азотът е много инертно вещество. За прекъсване на връзката N-N неговата молекула изисква енергия от порядъка на 200 kcal/ мол. Азотът обаче се свързва с повърхността на железния катализатор в атомно състояние и това изисква само 20 kcal./ мол. Водородните връзки с желязото са още по-лесно. Синтезът на амоняк протича по следния начин: Този пример илюстрира способността на катализатора да ускорява еднакво както предната, така и обратната реакция, т.е. фактът, че катализаторът не променя равновесното положение на химическата реакция.Хидрогениране на растително масло.
Една от най-важните реакции на хидрогениране на практика е непълното хидрогениране на растителни масла до маргарин, олио за готвене и други хранителни продукти. Растителните масла се получават от соя, памучни семена и други култури. Те включват естери, а именно триглицериди на мастни киселини с различна степен на ненаситеност. Олеинова киселина CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH има една двойна връзка C=C, линоловата киселина има две, а линоленовата киселина има три. Добавянето на водород за разрушаване на тази връзка предотвратява окисляването на маслата (гранясване). Това повишава тяхната точка на топене. Твърдостта на повечето от получените продукти зависи от степента на хидрогениране. Хидрогенирането се извършва в присъствието на фин прах от никел, отложен върху субстрат или никелов катализатор на Рейни във високо пречистена водородна атмосфера.Дехидрогениране. Дехидрогенирането също е индустриално важна каталитична реакция, въпреки че мащабът на нейното приложение е несравнимо по-малък. С негова помощ например се получава стирен, важен мономер. За да направите това, дехидрогенирайте етилбензен в присъствието на катализатор, съдържащ железен оксид; калий и някои структурни стабилизатори също допринасят за реакцията. В промишлен мащаб пропан, бутан и други алкани се дехидрогенират. Дехидрогенирането на бутан в присъствието на алуминиево-хромен катализатор произвежда бутени и бутадиен.киселинна катализа.
Каталитичната активност на голям клас катализатори се дължи на техните киселинни свойства. Според И. Бронстед и Т. Лоури киселината е съединение, способно да дарява протон. Силните киселини лесно даряват своите протони на основи. Концепцията за киселинност е доразвита в трудовете на G. Lewis, който определя киселината като вещество, способно да приеме електронна двойка от донорно вещество с образуването на ковалентна връзка поради социализацията на тази електронна двойка. Тези идеи, заедно с идеите за реакции, които образуват карбениеви йони, помогнаха да се разбере механизмът на различни каталитични реакции, особено тези, включващи въглеводороди.
Този пример илюстрира способността на катализатора да ускорява еднакво както предната, така и обратната реакция, т.е. фактът, че катализаторът не променя равновесното положение на химическата реакция.Хидрогениране на растително масло.
Една от най-важните реакции на хидрогениране на практика е непълното хидрогениране на растителни масла до маргарин, олио за готвене и други хранителни продукти. Растителните масла се получават от соя, памучни семена и други култури. Те включват естери, а именно триглицериди на мастни киселини с различна степен на ненаситеност. Олеинова киселина CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH има една двойна връзка C=C, линоловата киселина има две, а линоленовата киселина има три. Добавянето на водород за разрушаване на тази връзка предотвратява окисляването на маслата (гранясване). Това повишава тяхната точка на топене. Твърдостта на повечето от получените продукти зависи от степента на хидрогениране. Хидрогенирането се извършва в присъствието на фин прах от никел, отложен върху субстрат или никелов катализатор на Рейни във високо пречистена водородна атмосфера.Дехидрогениране. Дехидрогенирането също е индустриално важна каталитична реакция, въпреки че мащабът на нейното приложение е несравнимо по-малък. С негова помощ например се получава стирен, важен мономер. За да направите това, дехидрогенирайте етилбензен в присъствието на катализатор, съдържащ железен оксид; калий и някои структурни стабилизатори също допринасят за реакцията. В промишлен мащаб пропан, бутан и други алкани се дехидрогенират. Дехидрогенирането на бутан в присъствието на алуминиево-хромен катализатор произвежда бутени и бутадиен.киселинна катализа.
Каталитичната активност на голям клас катализатори се дължи на техните киселинни свойства. Според И. Бронстед и Т. Лоури киселината е съединение, способно да дарява протон. Силните киселини лесно даряват своите протони на основи. Концепцията за киселинност е доразвита в трудовете на G. Lewis, който определя киселината като вещество, способно да приеме електронна двойка от донорно вещество с образуването на ковалентна връзка поради социализацията на тази електронна двойка. Тези идеи, заедно с идеите за реакции, които образуват карбениеви йони, помогнаха да се разбере механизмът на различни каталитични реакции, особено тези, включващи въглеводороди. Силата на киселината може да се определи с помощта на набор от основи, които променят цвета си, когато се добави протон. Оказва се, че някои индустриално важни катализатори се държат като много силни киселини. Те включват катализатор на Friedel-Crafts като напр
HCl-AlCl 2 O 3 (или HAlCl 4 ) и алумосиликати. Силата на киселината е много важна характеристика, тъй като тя определя скоростта на протониране, ключова стъпка в процеса на киселинна катализа.Активността на катализатори като алумосиликати, използвани при крекинг на масло, се определя от наличието на киселини на Бронстед и Люис на повърхността им. Тяхната структура е подобна на структурата на силициевия диоксид (силициев диоксид), в който някои от атомите
Si 4+ заменени от атоми Al3+. Излишният отрицателен заряд, който възниква в този случай, може да бъде неутрализиран от съответните катиони. Ако катионите са протони, тогава алумосиликатът се държи като киселина на Brønsted: Активността на киселинните катализатори се определя от способността им да реагират с въглеводороди с образуването на карбениев йон като междинен продукт. Алкилкарбениевите йони съдържат положително зареден въглероден атом, свързан с три алкилови групи и/
или водородни атоми. Те играят важна роля като междинни съединения, образувани в много реакции, включващи органични съединения. Механизмът на действие на киселинните катализатори може да бъде илюстриран с примера на реакцията на изомеризациян
-бутан до изобутан в присъствието на HCl - AlCl 3 или Pt - Cl - Al 2 O 3 . Първо, малко количество олефин С 4 ч 8 свързва положително зареден водороден йон към киселинен катализатор, за да се образувам третичен карбениев йон. Тогава отрицателно зареден хидриден йон H - отделен от н
-бутан за образуване на изобутан и вторичен бутилкарб e няма d-йон. Последно в резултат на пренареждане ставатретичен въглехидратен йон. Тази верига може да продължи с елиминирането на хидриден йон от следващата молекулан- бутан и др.:
Активността на киселинните катализатори се определя от способността им да реагират с въглеводороди с образуването на карбениев йон като междинен продукт. Алкилкарбениевите йони съдържат положително зареден въглероден атом, свързан с три алкилови групи и/
или водородни атоми. Те играят важна роля като междинни съединения, образувани в много реакции, включващи органични съединения. Механизмът на действие на киселинните катализатори може да бъде илюстриран с примера на реакцията на изомеризациян
-бутан до изобутан в присъствието на HCl - AlCl 3 или Pt - Cl - Al 2 O 3 . Първо, малко количество олефин С 4 ч 8 свързва положително зареден водороден йон към киселинен катализатор, за да се образувам третичен карбениев йон. Тогава отрицателно зареден хидриден йон H - отделен от н
-бутан за образуване на изобутан и вторичен бутилкарб e няма d-йон. Последно в резултат на пренареждане ставатретичен въглехидратен йон. Тази верига може да продължи с елиминирането на хидриден йон от следващата молекулан- бутан и др.:  съществено o че третичните карбениеви йони са по-стабилни от първичните или вторичните. В резултат на това те присъстват главно на повърхността на катализатора и следователно основният продукт на изомеризацията на бутан е изобутанът.
съществено o че третичните карбениеви йони са по-стабилни от първичните или вторичните. В резултат на това те присъстват главно на повърхността на катализатора и следователно основният продукт на изомеризацията на бутан е изобутанът. Киселинните катализатори се използват широко в рафинирането на нефт - крекинг, алкилиране, полимеризация и изомеризация на въглеводороди
(Вижте също ХИМИЯ И МЕТОДИ НА РАФИНИРАНЕ НА НЕФЛО). Установен е механизмът на действие на карбениевите йони, които играят ролята на катализатор в тези процеси. В същото време те участват в редица реакции, включително образуването на малки молекули чрез разделяне на големи, комбинацията от молекули (олефин с олефин или олефин с изопарафин), структурно пренареждане чрез изомеризация, образуване на парафини и ароматни въглеводороди чрез пренос на водород.Едно от най-новите индустриални приложения на киселинната катализа е производството на оловни горива чрез добавяне на алкохоли към изобутилен или изоамилен. Добавянето на кислородни съединения към бензина намалява концентрацията на въглероден оксид в отработените газове. метил-
tert -бутилов етер (MTBE) с октаново число на смесване 109 също позволява да се получи високооктаново гориво, необходимо за работата на автомобилен двигател с висок коефициент на компресия, без да се прибягва до въвеждането на тетраетил олово в бензина. Организирано е и производството на горива с октанови числа 102 и 111.Основна катализа. Активността на катализаторите се определя от основните им свойства. Стар и добре познат пример за такива катализатори е натриевият хидроксид, използван за хидролизиране или осапуняване на мазнини при производството на сапун, а скорошен пример са катализаторите, използвани в производството на полиуретанови пластмаси и пяни. Уретанът се образува при взаимодействието на алкохол с изоцианат и тази реакция се ускорява в присъствието на основниамини. По време на реакцията основата се прикрепя към въглеродния атом в изоцианатната молекула, в резултат на което се появява отрицателен заряд върху азотния атом и активността му по отношение на алкохола се увеличава. Особено ефективен катализатор е триетилендиаминът. Полиуретановите пластмаси се получават чрез взаимодействие на диизоцианатите с полиоли (полиалкохоли). Когато изоцианатът реагира с вода, образуваният по-рано уретан се разлага, като се отделя CO2 . Когато смес от полиалкохоли и вода взаимодейства с диизоцианатите, получената полиуретанова пяна се пени с газообразни CO2. Катализатори с двойно действие. Тези катализатори ускоряват два вида реакции и дават по-добри резултати от преминаването на реагентите последователно през два реактора, всеки от които съдържа само един тип катализатор. Това се дължи на факта, че активните места на двойнодействащия катализатор са много близо един до друг и междинният продукт, образуван върху единия от тях, веднага се превръща в крайния продукт на другия.Комбинирането на катализатор, активиращ водорода, с катализатор, стимулиращ изомеризацията на въглеводороди, дава добър резултат. Активирането на водорода се извършва от някои метали, а изомеризацията на въглеводородите от киселини. Ефективен катализатор с двойно действие, използван при рафинирането на петрол за превръщане на нафта в бензин, е фино диспергирана платина, отложена върху кисел алуминиев триоксид. Превръщането на компоненти на нафта като метилциклопентан (MCP) в бензол увеличава октановото число на бензина. Първо, МСР се дехидрогенира върху платинената част на катализатора в олефин със същия въглероден скелет; след това олефинът преминава към киселинната част на катализатора, където изомеризира до циклохексен. Последният преминава към платинената част и се дехидрогенира до бензол и водород.
Катализаторите с двойно действие значително ускоряват реформирането на маслото. Използват се за изомеризиране на нормални парафини до изопарафини. Последните, кипящи при същите температури като бензиновите фракции, са ценни, защото имат по-високо октаново число в сравнение с обикновените въглеводороди. В допълнение, трансформацията
н -бутан до изобутан се придружава от дехидрогениране, което допринася за производството на MTBE.Стереоспецифична полимеризация. Важен крайъгълен камък в историятасе появи катализа откриване на каталитична полимеризацияа-олефини с образуването стереоредовенх полимер ов. Към катализаторите стереоспецифиченполимеризация са открити от К. Циглер, когато се опитва да обясни необичайните свойства на получените от него полимери. Друг химик, J. Natta, предполага, че уникалността на полимерите на Ziegler се определя от тяхната стереорегулярност. Експериментите с рентгенова дифракция показват, че полимерите, получени от пропилен в присъствието на катализатори на Ziegler, са силно кристални и наистина имат стереоправилна структура. За да опише такива подредени структури, Ната въведе термините "изотактичен “ и „синдиотактичен“. В случай, че няма поръчка, се използва терминът "атактичен": На повърхността на твърди катализатори, съдържащи преходни метали от групите, протича стереоспецифична реакция IVA - VIII (като Ti, V, Cr, Zr ), които са в непълно окислено състояние, и всяко съединение, съдържащо въглерод или водород, което е свързано с метал от групите I-III . Класически пример за такъв катализатор е утайката, образувана по време на взаимодействието TiCl 4 и Al(C 2 H 5 ) 3 в хептан, където титанът е редуциран до тривалентно състояние. Товаизключително активенсистемата катализира полимеризацията на пропилена при нормална температура и налягане.каталитично окисление.
Използването на катализатори за контрол на химията на окислителните процеси е от голямо научно и практическо значение. В някои случаи окисляването трябва да е пълно, например при неутрализиране на CO и въглеводородни замърсители в изгорелите газове на автомобила.По-често обаче е желателно окисляването да е непълно, например в много от процесите, широко използвани в индустрията за превръщане на въглеводороди в ценни междинни продукти, съдържащи такива функционални групи като -CHO, -COOH, -C-CO, - CN. В този случай се използват както хомогенни, така и хетерогенни катализатори. Пример за хомогенен катализатор е комплекс от преходен метал, който се използва за окислениедвойка
-ксилол до терефталова киселина, чиито естери служат като основа за производството на полиестерни влакна.Хетерогенни окислителни катализатори.
Тези катализатори обикновено са сложни твърди оксиди. Каталитичното окисление протича на два етапа. Първо, оксидният кислород се улавя от въглеводородна молекула, адсорбирана върху повърхността на оксида. Въглеводородът се окислява и оксидът се редуцира. Редуцираният оксид реагира с кислорода и се връща в първоначалното си състояние. С помощта на ванадиев катализатор се получава фталов анхидрид чрез частично окисление на нафталин или бутан.Производство на етилен чрез дехидродимеризация на метан.
Синтезът на етилен чрез дехидродимеризация позволява природният газ да бъде превърнат в по-лесно транспортируеми въглеводороди. реакция 2CH 4 + 2O 2 ® C 2 H 4 + 2H 2 O се извършва при 850 ° С използване на различни катализатори; най-добри резултати, получени с катализатор Li - MgO . Предполага се, че реакцията протича чрез образуване на метилов радикал чрез отделяне на водороден атом от молекула на метан. Разцепването се извършва от непълно редуциран кислород, например O 2
2-
. Метиловите радикали в газовата фаза се рекомбинират, за да образуват молекула на етан и се превръщат в етилен по време на последващо дехидрогениране. Друг пример за непълно окисление е превръщането на метанол във формалдехид в присъствието на сребърен или желязо-молибденов катализатор.зеолити. Зеолитите представляват специален клас хетерогенни катализатори. Това са алумосиликати с подредена структура на пчелна пита, чийто размер на клетката е сравним с размера на много органични молекули. Наричат се още молекулярни сита. Най-голям интерес представляват зеолитите, чиито пори са образувани от пръстени, състоящи се от 8–12 кислородни йона (фиг. 2). Понякога порите се припокриват, както при зеолита ZSM-5 (фиг. 3), който се използва за високо специфично превръщане на метанол във въглеводороди в бензиновата фракция. Бензинът съдържа значителни количества ароматни въглеводороди и поради това има високо октаново число. В Нова Зеландия, например, една трета от целия консумиран бензин се получава по тази технология. Метанолът се получава от вносен метан.
Катализаторите, които съставляват групата на Y-зеолитите, значително повишават ефективността на каталитичния крекинг поради предимно необичайните им киселинни свойства. Замяната на алумосиликатите със зеолити дава възможност за увеличаване на добива на бензин с повече от 20%.
На повърхността на твърди катализатори, съдържащи преходни метали от групите, протича стереоспецифична реакция IVA - VIII (като Ti, V, Cr, Zr ), които са в непълно окислено състояние, и всяко съединение, съдържащо въглерод или водород, което е свързано с метал от групите I-III . Класически пример за такъв катализатор е утайката, образувана по време на взаимодействието TiCl 4 и Al(C 2 H 5 ) 3 в хептан, където титанът е редуциран до тривалентно състояние. Товаизключително активенсистемата катализира полимеризацията на пропилена при нормална температура и налягане.каталитично окисление.
Използването на катализатори за контрол на химията на окислителните процеси е от голямо научно и практическо значение. В някои случаи окисляването трябва да е пълно, например при неутрализиране на CO и въглеводородни замърсители в изгорелите газове на автомобила.По-често обаче е желателно окисляването да е непълно, например в много от процесите, широко използвани в индустрията за превръщане на въглеводороди в ценни междинни продукти, съдържащи такива функционални групи като -CHO, -COOH, -C-CO, - CN. В този случай се използват както хомогенни, така и хетерогенни катализатори. Пример за хомогенен катализатор е комплекс от преходен метал, който се използва за окислениедвойка
-ксилол до терефталова киселина, чиито естери служат като основа за производството на полиестерни влакна.Хетерогенни окислителни катализатори.
Тези катализатори обикновено са сложни твърди оксиди. Каталитичното окисление протича на два етапа. Първо, оксидният кислород се улавя от въглеводородна молекула, адсорбирана върху повърхността на оксида. Въглеводородът се окислява и оксидът се редуцира. Редуцираният оксид реагира с кислорода и се връща в първоначалното си състояние. С помощта на ванадиев катализатор се получава фталов анхидрид чрез частично окисление на нафталин или бутан.Производство на етилен чрез дехидродимеризация на метан.
Синтезът на етилен чрез дехидродимеризация позволява природният газ да бъде превърнат в по-лесно транспортируеми въглеводороди. реакция 2CH 4 + 2O 2 ® C 2 H 4 + 2H 2 O се извършва при 850 ° С използване на различни катализатори; най-добри резултати, получени с катализатор Li - MgO . Предполага се, че реакцията протича чрез образуване на метилов радикал чрез отделяне на водороден атом от молекула на метан. Разцепването се извършва от непълно редуциран кислород, например O 2
2-
. Метиловите радикали в газовата фаза се рекомбинират, за да образуват молекула на етан и се превръщат в етилен по време на последващо дехидрогениране. Друг пример за непълно окисление е превръщането на метанол във формалдехид в присъствието на сребърен или желязо-молибденов катализатор.зеолити. Зеолитите представляват специален клас хетерогенни катализатори. Това са алумосиликати с подредена структура на пчелна пита, чийто размер на клетката е сравним с размера на много органични молекули. Наричат се още молекулярни сита. Най-голям интерес представляват зеолитите, чиито пори са образувани от пръстени, състоящи се от 8–12 кислородни йона (фиг. 2). Понякога порите се припокриват, както при зеолита ZSM-5 (фиг. 3), който се използва за високо специфично превръщане на метанол във въглеводороди в бензиновата фракция. Бензинът съдържа значителни количества ароматни въглеводороди и поради това има високо октаново число. В Нова Зеландия, например, една трета от целия консумиран бензин се получава по тази технология. Метанолът се получава от вносен метан.
Катализаторите, които съставляват групата на Y-зеолитите, значително повишават ефективността на каталитичния крекинг поради предимно необичайните им киселинни свойства. Замяната на алумосиликатите със зеолити дава възможност за увеличаване на добива на бензин с повече от 20%. В допълнение, зеолитите са селективни по отношение на размера на реагиращите молекули. Тяхната селективност се дължи на размера на порите, през които могат да преминават молекули само с определени размери и форми. Това се отнася както за изходните материали, така и за реакционните продукти. Например, поради стерични ограничения
двойка -ксилолът се образува по-лесно, отколкото по-обемисторто- и мета -изомери. Последните са "заключени" в порите на зеолита (фиг. 4).Използването на зеолити направи истинска революция в някои индустриални технологии – депарафиниране на газьол и машинно масло, получаване на химически междинни продукти за производство на пластмаси чрез алкилиране на ароматни съединения, изомеризация на ксилен, диспропорциониране на толуен и каталитичен крекинг на нефт. Тук зеолитът е особено ефективен
ZSM-5. Катализатори и опазване на околната среда. Използването на катализатори за намаляване на замърсяването на въздуха започна в края 19 40-те години. През 1952 г. A. Hagen-Smith открива, че въглеводородите и азотните оксиди, които са част от изгорелите газове, реагират на светлината, образувайки оксиданти (по-специално озон), които дразнят очите и дават други нежелани ефекти. Приблизително по същото време Y. Houdry разработва метод за каталитично пречистване на отработените газове чрез окисляване CO и въглеводороди до CO 2 и H 2 А. През 1970 г. беше формулирана Декларацията за чист въздух (ревизирана 1977 г., разширена през 1990 г.), която изискваше всички нови превозни средства от моделите от 1975 г. да бъдат оборудвани с каталитични конвертори. Установени са норми за състава на отработените газове. Тъй като оловните съединения са добавени към катализаторите за бензинова отрова, е приета програма за постепенно премахване. Обърнато е внимание и на необходимостта от намаляване на съдържанието на азотни оксиди.Специално за автомобилни конвертори са създадени катализатори, при които активните компоненти се отлагат върху керамичен субстрат със структура на пчелна пита, през чиито клетки преминават отработените газове. Субстратът е покрит с тънък слой метален оксид, например
Al2O3 върху който се нанася катализатор - платина, паладий или родий. Съдържанието на азотни оксиди, образувани при изгарянето на природни горива в ТЕЦ, може да се намали чрез добавяне на малки количества амоняк към димните газове и преминаването им през титаниево-ванадиев катализатор.Ензими. Ензимите са естествени катализатори, които регулират биохимичните процеси в жива клетка. Те участват в процесите на обмен на енергия, разграждането на хранителните вещества, реакциите на биосинтеза. Много сложни органични реакции не могат да протичат без тях. Ензимите функционират при обикновена температура и налягане, имат много висока селективност и са в състояние да увеличат скоростта на реакциите с осем порядъка. Въпреки тези предимства, само прибл. От 15 000 известни ензими, 20 се използват в голям мащаб.Човекът използва ензими от хиляди години за печене на хляб, производство на алкохолни напитки, сирене и оцет. Сега ензимите се използват и в промишлеността: при преработката на захар, при производството на синтетични антибиотици, аминокиселини и протеини. Към детергентите се добавят протеолитични ензими, които ускоряват процесите на хидролиза.
С помощта на бактерии
Clostridium acetobutylicum H. Weizmann извършва ензимното превръщане на нишестето в ацетон и бутилов алкохол. Този метод за получаване на ацетон е широко използван в Англия по време на Първата световна война, а по време на Втората световна война с негова помощ в СССР се произвежда бутадиенов каучук.Изключително голяма роля изигра използването на ензими, произведени от микроорганизми за синтеза на пеницилин, както и стрептомицин и витамин
B12. Ензимно произведен етилов алкохол се използва широко като автомобилно гориво. В Бразилия повече от една трета от приблизително 10 милиона автомобила работят с 96% етилов алкохол, получен от захарна тръстика, а останалата част от смес от бензин и етилов алкохол (20%). Технологията за производство на гориво, което е смес от бензин и алкохол, е добре развита в САЩ. През 1987 г. ок. 4 милиарда литра алкохол, от които приблизително 3,2 милиарда литра са използвани като гориво. Различни приложения се срещат и в т.нар. имобилизирани ензими. Тези ензими са свързани с твърд носител, като силикагел, върху който се прекарват реагентите. Предимството на този метод е, че осигурява ефективен контакт на субстратите с ензима, разделяне на продуктите и запазване на ензима. Един пример за промишленото използване на имобилизирани ензими е изомеризациятад - глюкоза до фруктоза. ТЕХНОЛОГИЧНИ АСПЕКТИ Съвременните технологии не могат да си представят без използването на катализатори. Каталитичните реакции могат да протичат при температури до 650°С° C и налягане от 100 атм или повече. Това налага решаването на проблемите, свързани с контакта между газообразни и твърди вещества и с пренасянето на частиците на катализатора по нов начин. За да бъде процесът ефективен, неговото моделиране трябва да вземе предвид кинетичните, термодинамичните и хидродинамичните аспекти. Тук широко се използва компютърно моделиране, както и нови инструменти и методи за управление на технологични процеси.През 60-те години на миналия век е постигнат значителен напредък в производството на амоняк. Използването на по-активен катализатор направи възможно намаляването на температурата на производство на водород по време на разлагането на водната пара, поради което беше възможно да се понижи налягането и следователно да се намалят производствените разходи, например чрез използването на по-евтини центробежни компресори. В резултат на това цената на амоняка падна с повече от половината, имаше огромно увеличение на производството му и във връзка с това - увеличение на производството на храни, тъй като амонякът е ценен тор.
Методи. Изследванията в областта на катализата се извършват с помощта на традиционни и специални методи. Използват се радиоактивни етикети, рентгенова, инфрачервена и Раманова (Раманова) спектроскопия, методи за електронна микроскопия; извършват се кинетични измервания, изследва се влиянието на методите за получаване на катализатори върху тяхната активност. От голямо значение е определянето на повърхностната площ на катализатора по метода на Brunauer-Emmett-Teller (метод BET), базиран на измерване на физическата адсорбция на азот при различни налягания. За да направите това, определете количеството азот, необходимо за образуването на монослой върху повърхността на катализатора, и, като знаете диаметъра на молекулата N 2 , изчислете общата площ. В допълнение към определянето на общата повърхност се извършва хемосорбция на различни молекули, което дава възможност да се оцени броят на активните центрове и да се получи информация за техните свойства.Изследователите имат на разположение различни методи за изследване на повърхностната структура на катализаторите на атомно ниво. Уникалната информация ви позволява да получите метод
EXAFS . Сред спектроскопските методи все по-често се използват UV, рентгенова и Оже фотоелектронна спектроскопия. Голям интерес представлява вторичната йонна масспектрометрия и спектроскопията на йонно разсейване. ЯМР измерванията се използват за изследване на природата на каталитичните комплекси. Сканиращият тунелен микроскоп ви позволява да видите подреждането на атомите на повърхността на катализатора. ПЕРСПЕКТИВИ Мащабът на каталитичните процеси в индустрията се увеличава всяка година. Все по-често се използват катализатори за неутрализиране на замърсителите на околната среда. Нараства ролята на катализаторите в производството на въглеводороди и кислород-съдържащи синтетични горива от газ и въглища. Изглежда много обещаващо да се създадат горивни клетки за икономично преобразуване на горивната енергия в електрическа енергия.Новите концепции за катализа ще направят възможно получаването на полимерни материали и други продукти с много ценни свойства, подобряване на методите за производство на енергия, увеличаване на производството на храни, по-специално чрез синтезиране на протеини от алкани и амоняк с помощта на микроорганизми. Възможно е да се разработят генетично инженерни методи за производство на ензими и органометални съединения, които се доближават до естествените биологични катализатори по тяхната каталитична активност и селективност.
ЛИТЕРАТУРАГейтс Б.К. Химия на каталитичните процеси . М., 1981Боресков Г.К. Катализа. Въпроси на теория и практика . Новосибирск, 1987 г
Ганкин В.Ю., Ганкин Ю.В.Нова обща теория на катализа . Л., 1991
Токабе К. Катализатори и каталитични процеси . М., 1993г
С. И. ЛЕВЧЕНКОВ
ФИЗИЧНА И КОЛОИДНА ХИМИЯ
Реферат от лекции за студенти от Биологическия факултет на Южния федерален университет (RSU)
2.3 КАТАЛИТИЧНИ ПРОЦЕСИ
Скоростта на химическа реакция при дадена температура се определя от скоростта на образуване на активирания комплекс, която от своя страна зависи от стойността на енергията на активиране. При много химични реакции структурата на активирания комплекс може да включва вещества, които не са стехиометрично реагенти; Очевидно в този случай се променя и стойността на енергията на активиране на процеса. В случай на наличие на няколко преходни състояния, реакцията ще протече главно по пътя с най-ниска бариера за активиране.
Катализата е явлението на промяна на скоростта на химическа реакция в присъствието на вещества, чието състояние и количество остават непроменени след реакцията.
Разграничаване положителени отрицателенкатализа (съответно увеличаване и намаляване на скоростта на реакцията), въпреки че често терминът "катализа" означава само положителна катализа; отрицателен катализ се нарича инхибиране.
Вещество, което е част от структурата на активиран комплекс, но не е стехиометрично реагент, се нарича катализатор. Всички катализатори се характеризират с такива общи свойства като специфичност и селективност на действие.
СпецифичностКатализаторът се крие в способността му да ускорява само една реакция или група реакции от същия тип и да не влияе на скоростта на други реакции. Например, много преходни метали (платина, мед, никел, желязо и др.) са катализатори за процеси на хидрогениране; алуминиевият оксид катализира реакциите на хидратация и др.
Селективносткатализатор - способността за ускоряване на една от паралелните реакции, възможни при дадени условия. Поради това е възможно, като се използват различни катализатори, да се получат различни продукти от едни и същи изходни материали:
|
: CO + H 2 ––> CH 3 OH |
: C 2 H 5 OH -> C 2 H 4 + H 2 O |
|
: CO + H 2 -> CH 4 + H 2 O |
: C 2 H 5 OH -> CH 3 CHO + H 2 |
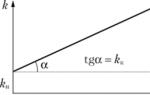
Причината за повишаване на скоростта на реакцията при положителна катализа е намаляването на енергията на активиране, когато реакцията протича през активирания комплекс с участието на катализатора (фиг. 2.8).
Тъй като, според уравнението на Арениус, константата на скоростта на химическа реакция е експоненциално зависима от енергията на активиране, намаляването на последната причинява значително увеличение на константата на скоростта. Всъщност, ако приемем, че предекспоненциалните фактори в уравнението на Арениус (II.32) за каталитични и некаталитични реакции са близки, тогава за съотношението на константите на скоростта можем да запишем:
Ако ΔE A = –50 kJ/mol, тогава съотношението на константите на скоростта ще бъде 2,7·10 6 пъти (в действителност, на практика такова намаляване на E A увеличава скоростта на реакцията приблизително 10 5 пъти).
Трябва да се отбележи, че наличието на катализатор не влияе върху величината на промяната в термодинамичния потенциал в резултат на процеса и следователно, нито един катализатор не може да направи термодинамично невъзможен процес спонтанен (на процес, чието ΔG (ΔF) е по-голямо от нула). Катализаторът не променя стойността на равновесната константа за обратими реакции; ефектът на катализатора в този случай се състои само в ускоряване на постигането на равновесно състояние.
В зависимост от фазовото състояние на реагентите и катализатора се разграничават хомогенна и хетерогенна катализа.

Ориз. 2.8Енергийна диаграма на химическа реакция без катализатор (1)
и в присъствието на катализатор (2).
2.3.1 Хомогенна катализа.
Хомогенната катализа е каталитична реакция, при която реагентите и катализаторът са в една и съща фаза. В случай на хомогенни каталитични процеси, катализаторът образува междинни реактивни продукти с реагентите. Помислете за някаква реакция
A + B ––> C
В присъствието на катализатор се извършват две бързи стъпки, които водят до образуването на частици от междинното съединение АА и след това (чрез активирания комплекс AVK #) крайния реакционен продукт с регенерация на катализатора:
A + K ––> AK
AK + V -> C + K
Пример за такъв процес е разлагането на ацеталдехид, чиято енергия на активиране е E A = 190 kJ/mol:
CH 3 CHO -> CH 4 + CO
В присъствието на йодни пари този процес протича на два етапа:
CH 3 CHO + I 2 ––> CH 3 I + HI + CO
CH 3 I + HI -> CH 4 + I 2
Намаляването на енергията на активиране на тази реакция в присъствието на катализатор е 54 kJ/mol; в този случай константата на скоростта на реакцията се увеличава приблизително с коефициент 105. Най-често срещаният тип хомогенна катализа е киселинната катализа, при която водородните йони Н+ действат като катализатор.
2.3.2 Автокатализа.
Автокатализа- процесът на каталитично ускоряване на химическа реакция от един от нейните продукти. Пример е хидролизата на естери, катализирана от водородни йони. Образуваната по време на хидролиза киселина се дисоциира с образуването на протони, които ускоряват реакцията на хидролиза. Характеристика на автокаталитичната реакция е, че тази реакция протича с постоянно повишаване на концентрацията на катализатора. Следователно в началния период на реакцията скоростта й се увеличава, а на следващите етапи, в резултат на намаляване на концентрацията на реагентите, скоростта започва да намалява; кинетичната крива на продукта от автокаталитична реакция има характерна S-образна форма (фиг. 2.9).

Ориз. 2.9Кинетична крива на продукта от автокаталитична реакция
2.3.3 Хетерогенна катализа.
хетерогенна катализа - каталитични реакции, протичащи на границата между фазите, образувани от катализатора и реагентите. Механизмът на хетерогенните каталитични процеси е много по-сложен, отколкото в случая на хомогенна катализа. Във всяка хетерогенна каталитична реакция могат да се разграничат най-малко шест етапа:
1. Дифузия на изходните материали към повърхността на катализатора.
2. Адсорбция на изходни материали на повърхността с образуване на някакво междинно съединение:
A + B + K -–> AVK
3. Активиране на адсорбираното състояние (необходимата енергия за това е истинската енергия на активиране на процеса):
AVK ––> AVK #
4. Разлагане на активирания комплекс с образуване на адсорбирани реакционни продукти:
ABK # ––> CDK
5. Десорбция на реакционните продукти от повърхността на катализатора.
СДК ––> С + D + К
6. Дифузия на реакционните продукти от повърхността на катализатора.
Специфична характеристика на хетерокаталитичните процеси е способността на катализатора да се насърчава и отравя.
Промоция– повишаване на активността на катализатора в присъствието на вещества, които сами по себе си не са катализатори на този процес (промотори). Например за реакция, катализирана от метален никел
CO + H 2 -> CH 4 + H 2 O
въвеждането на малък примес от церий в никеловия катализатор води до рязко повишаване на активността на катализатора.
Отравяне- рязко намаляване на активността на катализатора в присъствието на определени вещества (т.нар. каталитични отрови). Например, за реакцията на синтез на амоняк (катализатор - гъба желязо), присъствието на кислородни или серни съединения в реакционната смес причинява рязко намаляване на активността на железния катализатор; в същото време способността на катализатора да адсорбира изходните вещества намалява много леко.
За да обясни тези особености на хетерогенните каталитични процеси, Г. Тейлър направи следното предположение: не цялата повърхност на катализатора е каталитично активна, а само някои от неговите участъци – т.нар. активни центрове , които могат да бъдат различни дефекти в кристалната структура на катализатора (например издатини или вдлъбнатини по повърхността на катализатора). Понастоящем няма единна теория за хетерогенната катализа. За метални катализатори, a теория на мултиплета . Основните положения на мултиплетната теория са както следва:
1. Активният център на катализатора е съвкупност от определен брой адсорбционни центрове, разположени на повърхността на катализатора в геометрично съответствие със структурата на претърпящата трансформация молекула.
2. При адсорбиране на реагиращи молекули върху активния център се образува мултиплетен комплекс, в резултат на което връзките се преразпределят, което води до образуване на реакционни продукти.
Теорията на мултиплетите понякога се нарича теория на геометричното сходство между активния център и реагиращите молекули. При различните реакции броят на адсорбционните центрове (всеки от които е идентифициран с метален атом) в активния център е различен - 2, 3, 4 и т.н. Такива активни центрове се наричат съответно дублет, триплет, четворен и т.н. (в общия случай мултиплет, на който теорията дължи името си).
Например, според теорията на мултиплетите, дехидрогенирането на наситени едновалентни алкохоли става на дублет, а дехидрогенирането на циклохексан - на секстет (фиг. 2.10 - 2.11); Теорията на мултиплета направи възможно свързването на каталитичната активност на металите с техния атомен радиус.
 Ориз. 2.10Дехидрогениране на алкохоли върху дублет
Ориз. 2.10Дехидрогениране на алкохоли върху дублет
 Ориз. 2.11Дехидрогениране на циклохексан върху секстет
Ориз. 2.11Дехидрогениране на циклохексан върху секстет
2.3.4 Ензимна катализа.
Ензимна катализа - каталитични реакции, протичащи с участието на ензими - биологични катализатори от протеинова природа. Ензимната катализа има две характерни черти:
1. висока активност , което е с няколко порядъка по-високо от активността на неорганичните катализатори, което се обяснява с много значително намаляване на енергията на активиране на процеса от ензими. Така константата на скоростта на реакцията на разлагане на водороден пероксид, катализирана от йони Fe 2+, е 56 s -1; константата на скоростта на същата реакция, катализирана от ензима каталаза, е 3,5·10 7 , т.е. реакцията в присъствието на ензима протича милион пъти по-бързо (енергиите на активиране на процесите са съответно 42 и 7,1 kJ/mol). Константите на скоростта на хидролиза на урея в присъствието на киселина и уреаза се различават с тринадесет порядъка, възлизащи на 7,4·10 -7 и 5·10 6 s -1 (енергията на активиране е съответно 103 и 28 kJ/mol).
2. Висока специфичност . Например, амилазата катализира разграждането на нишестето, което е верига от идентични глюкозни единици, но не катализира хидролизата на захарозата, чиято молекула е съставена от глюкозни и фруктозни фрагменти.
Според общоприетите представи за механизма на ензимната катализа, субстрат S и ензим F са в равновесие с много бързо образувания ензим-субстратен комплекс FS, който се разлага относително бавно до реакционния продукт P с освобождаването на свободен ензим; по този начин, етапът на разлагане на комплекса ензим-субстрат в реакционни продукти е определящ (ограничаващ).
F+S<––>FS ––> F+P
Изследването на зависимостта на скоростта на ензимната реакция от концентрацията на субстрата при постоянна концентрация на ензима показа, че с увеличаване на концентрацията на субстрата скоростта на реакцията първо се увеличава и след това престава да се променя (фиг. 2.12) и зависимостта на скоростта на реакцията от концентрацията на субстрата се описва със следното уравнение:
 (II.45)
(II.45)
Въведение
1. Общи положения и закономерности на катализа
2. Хомогенна катализа
3. Киселинен и основен катализ
4. Хомогенни каталитични реакции, катализирани от комплексни съединения
5. Ензимна катализа
6. Хетерогенна катализа
Заключение
Списък на използваните източници
Въведение
Катализата е феномен на промяна в скоростта на реакцията в присъствието на катализатори. Реакциите с участието на катализатори се наричат каталитични. Веществата, които увеличават скоростта на химическата реакция, като същевременно остават непроменени в резултат на цялостната реакция, се наричат катализатори.
Има много различни видове катализатори и много различни механизми на действие. Катализаторът преминава през цикли, в които първо се свързва, след това се регенерира, отново се свързва и така нататък много пъти. Катализаторът позволява на реакцията да протича по различен начин и с по-бърза скорост, отколкото при липса на катализатор. Скоростта може да се увеличи чрез намаляване на енергията на активиране, увеличаване на предекспоненциалния фактор или и двете.
Катализаторът едновременно ускорява както предната, така и обратната реакция, така че равновесната константа на общата реакция остава непроменена. Ако това не беше така, тогава би било възможно да се конструира вечен двигател с помощта на катализатор за регенериране на материята
1. Общи положения и закономерности на катализа
Катализаторите се делят на хомогенни и хетерогенни. Хомогенният катализатор е в една и съща фаза с реагентите, хетерогенният образува независима фаза, отделена с интерфейс от фазата, в която са разположени реагентите. Типични хомогенни катализатори са киселини и основи. Металите, техните оксиди и сулфиди се използват като хетерогенни катализатори.
Реакции от един и същи тип могат да протичат както с хомогенни, така и с хетерогенни катализатори. Така наред с киселинните разтвори се използват твърди Al 2 O 3 , TiO 2 , ThO 2 , алумосиликати и зеолити с киселинни свойства. Хетерогенни катализатори с основни свойства: CaO, BaO, MgO.
Хетерогенните катализатори, като правило, имат силно развита повърхност, за която се разпределят върху инертен носител (силикагел, алуминиев оксид, активен въглен и др.).
За всеки тип реакция само определени катализатори са ефективни. В допълнение към вече споменатите киселинно-основни, има окислително-редукционни катализатори; те се характеризират с наличието на преходен метал или негово съединение (Co +3, V 2 O 5 +, MoO 3). В този случай катализата се извършва чрез промяна на степента на окисление на преходния метал.
Много реакции се извършват с помощта на катализатори, които действат чрез координацията на реагентите при атома или йона на преходния метал (Ti, Rh, Ni). Такава катализа се нарича координационна катализа.
Ако катализаторът има хирални свойства, тогава от оптически неактивен субстрат се получава оптически активен продукт.
В съвременната наука и технология често се използват системи от няколко катализатора, всеки от които ускорява различни етапи на реакцията. Катализаторът може също да увеличи скоростта на един от етапите на каталитичния цикъл, осъществяван от друг катализатор. Тук се извършва "катализа на катализа" или катализа от второ ниво.
Ензимите играят ролята на катализатори в биохимичните реакции.
Катализаторите трябва да се разграничават от инициаторите. Например, пероксидите се разпадат на свободни радикали, които могат да инициират радикални верижни реакции. Инициаторите се консумират по време на реакцията, така че не могат да се считат за катализатори.
Инхибиторите понякога погрешно се считат за отрицателни катализатори. Но инхибиторите, като радикални верижни реакции, реагират със свободните радикали и за разлика от катализаторите не се запазват. Други инхибитори (каталитични отрови) се свързват с катализатора и го дезактивират, което е по-скоро потискане на катализа, отколкото отрицателна катализа. Отрицателната катализа е невъзможна по принцип: тя би осигурила по-бавен път на реакцията, но реакцията, разбира се, ще върви по по-бърз, в този случай, некатализиран път.
Катализаторът може да бъде един от реакционните продукти. В този случай реакцията се нарича автокаталитична, а самото явление се нарича автокатализа. Например при окисляването на Fe 2+ с Mn0 4
5Fe 2+ + Mn0 4 - + 8H+ \u003d 5Fe 3+ + Mn 2+ + 4H 2 0
получените Mn 2+ йони катализират протичането на реакцията.
Каталитичните реакции са изключително чести в природата. Най-изненадващите от тях са реакциите с ензими, които катализират много реакции в живите организми. Катализаторите се използват широко в промишлеността. Производство на азотна и сярна киселини, амоняк, производство на синтетичен каучук и др. невъзможно без каталитични реакции. В производството на лекарствени вещества се използват катализатори: фенацетин, гваякол, халогенни производни на ароматни съединения и др. Като катализатори се използват оксиди Mn(IV), Ni, Co, Fe, A1C1 3 , TeC1 3 .
Има хомогенна и хетерогенна катализа, но за всеки от тях основните закономерности са следните:
1. Катализаторът участва активно в елементарния акт на реакцията, образувайки или междинни съединения с един от участниците в реакцията, или активиран комплекс с всички реагенти. След всеки елементарен акт той се регенерира и може да взаимодейства с нови молекули на реагиращи вещества.
2. Скоростта на каталитичната реакция е пропорционална на количеството катализатор.
3. Катализаторът има селективност на действие. Може да промени скоростта на една реакция и да не повлияе на скоростта на друга.
4. Катализаторът позволява на реакцията да протича по различен начин и с по-бърза скорост, отколкото при липса на катализатор.
Скоростта може да се увеличи чрез намаляване на енергията на активиране, увеличаване на предекспоненциалния фактор или и двете. Например, термичното разлагане на ацеталдехид CH 3 CHO CH 4 + CO се катализира от йодни пари, което води до намаляване на енергията на активиране с ~55 kJ/mol. Това намаление води до увеличаване на константата на скоростта с коефициент от около 10 000.
5. Катализаторът не влияе на положението на термодинамичното равновесие. Той еднакво променя скоростта както на предните, така и на обратните реакции.
6. Когато се добавят определени вещества, наречени промотори, активността на катализатора се увеличава; добавянето на инхибитори намалява скоростта на реакцията.
2. Хомогенна катализа
При хомогенна катализа катализаторът е молекула или йон в хомогенен разтвор. В случай на хомогенна катализа, катализаторът и всички реагенти образуват една обща фаза.
Основното допускане на теорията на хомогенната катализа е идеята, че в хода на реакцията се образуват нестабилни междинни съединения на катализатора с реагентите, които след това се разлагат с регенерацията на катализатора:
A + B + K = (A-B-K)* D + K
Скоростта на тази реакция
v=k н° С А° С Б° С К
е пропорционална на концентрацията на катализатора, а константата на скоростта се подчинява на уравнението на Арениус. Тази реакция може да протече на два етапа:
катализа хомогенна киселина ензимна хетерогенна
В този случай са възможни два случая. В първия етап скоростта на разлагане на комплекса в катализатора и първоначалния продукт е много по-висока от скоростта на втория етап, в който се образува крайният продукт. Следователно концентрацията на комплекси, които се наричат комплекси на Арениус в този тип катализа, е ниска. Във втория случай скоростта на разлагане на комплекса е съизмерима със скоростта на втория етап. Концентрацията на междинния комплекс е значителна и стационарна. Комплексите от този тип се наричат комплекси на Van't Hoff.
Вторият случай, като по-типичен, ще бъде разгледан по-подробно. Тъй като междинното съединение AA е в равновесие с изходните материали, скоростите на директната (v 1) и обратната (v 2) реакция (1) трябва да са равни. Съставяйки кинетични уравнения за тях, получаваме:
където (С Да се"-- С АК") е концентрацията на катализатора, който не реагира; С А,С АК"-- равновесни концентрации на вещество А и междинно съединение АА, съответно.
От (2) намираме концентрацията на междинното съединение:
Общата скорост на целия процес (v) се определя от скоростта на най-бавния етап, в този случай втория. Тогава
Замествайки в (4) концентрацията на междинното съединение (3), получаваме:
Уравнение (5) показва възможността за съществуване на два ограничаващи режима:
И в двата случая скоростта на реакцията е право пропорционална на концентрацията на катализатора, но редът на реакцията за изходните материали е различен. В първия случай е равно на две, а във втория - на едно. Извън ограничителните режими, редът на реакцията ще бъде дробен.
Пример за хомогенна катализа е реакцията на термично разлагане на ацеталдехид CH 3 CH 4 + CO, катализирана от йодни пари. При липса на йодни пари Е а=191.0 kJ/mol, в тяхно присъствие Е а= 136,0 kJ/mol. Константата на скоростта се увеличава с коефициент 10 000. Това е така, защото реакцията протича на два етапа:
CH 3 SON + I 2 \u003d CH 3 I + HI + CO
CH 3 I + HI \u003d CH 4 + I 2
Енергията на активиране на всеки етап е по-малка от енергията на активиране на некаталитичната реакция.
Хомогенната катализа включва много киселинно-алкални реакции, реакции на комплексообразуване, редокс реакции, множество реакции на хидрогениране, сулфатиране и др.
3. Киселинен и основен катализ
Киселините и основите в много реакции действат като катализатор, т.е., участвайки в реакцията, самите те не се консумират (реакции на хидролиза, алкилиране, естерификация и т.н. Има три вида киселинно-алкална катализа:
1) специфична киселинна (основна) катализа, при която като катализатор служат съответно Н + или ОН йони;
2) тотална киселинна (алкална) катализа, която се извършва от всеки донор на протони (акцептор);
3) електрофилна (нуклеофилна) катализа, извършена от киселини и основи на Люис.
Константа на скоростта на първата поръчка кза реакцията в буферен разтвор може да бъде линейна функция на [H + ], [OH - ], [HA], [A - ], т.е.:
k \u003d k 0 + k 1 [H+] + k 2 [OH -] + k 3 [ON] + k 4 [A -]
В този израз к 0 -- скоростна константа от първи порядък при отсъствие на всички каталитични йони: [H + ], [OH - ], [NA], [A - ], a k t -- каталитични коефициенти.
Ако само терминът k 1 [H + ] играе значителна роля, тогава те казват, че реакцията се проявява в специфична катализа от водородни йони. Ако един член преобладава к 3 [HA], се казва, че реакцията е обект на обща киселинна катализа. Ако членът преобладава к 4 [A - ], тогава се казва, че реакцията е подложена на действието на катализа с обща база.
За специфична киселинно-алкална катализа, когато скоростта на некаталитичната реакция е ниска (к 0 = 0) може да се представи в логаритмична форма:
За киселинни разтвори:
За алкални разтвори:
Уравненията показват, че в случай на специфична киселинно-алкална катализа, логаритъмът на константата на скоростта зависи линейно от рН на средата.
Механизмът на каталитичното действие на водородните йони е, че се образува междинно съединение от протон и молекула на изходното вещество. Благодарение на този процес химичните връзки, присъстващи в изходното вещество, се разхлабват, енергията на активиране се намалява и след това протонираната форма на BH + се разлага в продукт на реакцията и катализатор.
4. Хомогенни каталитични реакции, катализирани от комплексни съединения
Реакциите на редукция, хидрогениране, окисляване, изомеризация, полимеризация при промишлени условия се извършват в присъствието на катализатори - комплексни съединения (метални йони от група VIII от периодичната таблица Fe, Co, Ni, Ru, както и Cu, Fg , Hg, Cr, Mn). Същността на каталитичното действие се крие във факта, че металните йони действат като донори или акцептори на електрони. Химичното взаимодействие между реагиращи молекули, координирани около централния метален йон, се улеснява от поляризация на молекулите и намаляване на енергията на отделните връзки. Централният метален йон е мост, който улеснява електронните преходи между реагиращи молекули.
Каталитичната активност на метален йон зависи от енергията на свързване на йона с участниците в реакцията. Ако енергията на свързване е висока или ниска, металният йон проявява слаба каталитична активност. В първия случай металните йони са толкова силно свързани с реагиращите молекули, че се отстраняват от реакцията. Във втория случай, реагиращите молекули не могат да изместят други лиганди, присъстващи в разтвора. Получават се координационно наситени комплекси, които не са активни катализатори.
Поради широките възможности за регулиране на състава на сложните катализатори, стана възможно да се симулират редица реакции, включващи ензими, съдържащи йони на елементи от група VIII.
5. Ензимна катализа
Ензимите са най-невероятните катализатори. Много реакции в живите организми са свързани с тях и затова често се наричат биологични катализатори. Ензимната катализа е по-сложен феномен от конвенционалната катализа. Високата организация на процесите на ензимна катализа се определя от особеността на взаимодействието в живия организъм, свързана със специална комбинация от молекулярната структура на ензими и субстрати, които се наричат реагенти в ензимните реакции.
Ензимите са протеини, т.е. са изградени от аминокиселини, свързани с пептидни връзки. Ензимната молекула има редуващи се полярни групи COOH, NH 2 , NH, OH, SH и др., както и хидрофобни групи. Първичната структура на ензима се определя от реда на редуване на различните аминокиселини. В резултат на термично хаотично движение, ензимната макромолекула се огъва и се навива в хлабави топки. Между отделните участъци от полипептидната верига възниква междумолекулно взаимодействие, което води до образуване на водородни връзки. Вторичната структура на ензима се появява под формата на рохкава среда. За всеки ензим вторичната структура е съвсем определена. Активният каталитичен център на ензима включва групи, които ориентират молекулите на субстрата в определена позиция. Активният център е като матрица, която може да включва само молекула с определена структура. Механизмът на ензимната катализа се състои във взаимодействието на активните места на ензима със субстрата за образуване на комплекс ензим-субстрат, който след това претърпява няколко трансформации, в резултат на което се появява продукт на реакцията. Всяка от междинните стъпки се характеризира с по-ниска енергия на активиране, което допринася за бързото протичане на реакцията. Това обяснява високата активност на ензимите.
Ензимите са разделени на класове в зависимост от вида на реакцията, която катализират: оксидоредуктази (катализират редокс реакции), трансферази (катализират прехвърлянето на химични групи от едно съединение в друго), хидролази (катализират реакции на хидролиза), лиази (разрушават различни връзки), изомерази (извършват изомерни трансформации), лигази (катализират реакции на синтез). Както се вижда, ензимите се различават по специфичност и селективност. Някои катализират цял клас реакции от определен тип, други катализират само една реакция.
Много ензими съдържат метални йони (метални ензими). В металоензимите металните йони образуват хелатни комплекси, които осигуряват активната структура на ензима. Металите с различна степен на окисление (Fe, Mn, Cu) участват в редокс реакциите, осъществявайки прехвърлянето на електрони към окислителя. Известни са няколко десетки органични съединения, които изпълняват функциите на пренос на водород и електрони. Те съдържат производни на витамини.
Йоните на тежките метали (Ag + , Hg + , Pb 2+) могат да блокират активните групи ензими.
За оценка на действието на различни ензими е въведено понятието молекулярна активност, която се определя от броя на молекулите на субстрата, които се превръщат под действието на една ензимна молекула в минута. Най-активният от известните ензими е карбоанхидразата, чиято молекулярна активност е ~36 милиона молекули в минута.
Скоростта на реакцията, катализирана от ензима, е право пропорционална на концентрацията на ензима. При ниска концентрация на субстрата реакцията е от първи ред по отношение на субстрата. При високи концентрации скоростта на реакцията остава постоянна и редът на реакцията става нула (ензимът е напълно наситен със субстрата). Скоростта на реакцията зависи от температурата и киселинността на средата.
Ензимната катализа играе огромна роля във всички прояви на живота, където говорим за живи същества. За повишаване на жизнената активност на организма и подобряване на метаболизма са създадени много ензимни препарати, които се използват като лекарства. Ензимните препарати се използват широко при нарушения на функцията на стомашно-чревния тракт, свързани с недостатъчно производство на храносмилателни ензими. Така че при някои форми на гастрит се използват пепсин или панкреатинови препарати. Ензимите се използват успешно и в случаите, когато е необходимо да се унищожат големи количества протеинови образувания (при изгаряния, гнойни рани, гнойно-възпалителни заболявания на белите дробове и др.). В тези случаи се използват протолитични ензими, водещи до бърза хидролиза на белтъците и улесняващи резорбцията на гнойните натрупвания. За лечение на редица инфекциозни заболявания се използват лизозимни препарати, които разрушават мембраната на някои патогенни бактерии. Ензимите, които разтварят кръвните съсиреци (кръвни съсиреци вътре в кръвоносните съдове), са много важни. Това е плазмин, открит в кръвта; панкреатични ензими - трипсин и химотрипсин. На тяхна основа с различни добавки са създадени лечебни ензимни препарати - стрептокиназа, стрептаза и други, използвани в медицината.
6. Хетерогенна катализа
Хетерогенната катализа се извършва на интерфейса. Първата наблюдавана хетерогенна каталитична реакция е проведена от Priestley (1778) дехидратация на етилов алкохол върху активна глина:
C 2 H 5 OH -- C 2 H 4 + H 2O
През първата половина на 19 век голям брой произведения са посветени на хетерогенната катализа. Много трудове са посветени на теоретичното обяснение на каталитичното действие на твърдо вещество. В бъдеще развитието на доктрината върви както по пътя на натрупване на експериментални данни, разработване на методи за приготвяне на катализатори, откриване и изучаване на нови каталитични процеси, въвеждане на катализа в химическата индустрия, така и по пътя на развитието на теорията за хетерогенната катализа . Успехът на теоретиците обаче беше много по-скромен от успеха на експериментаторите. И това не е случайно.
Въпреки че няма фундаментална разлика между каталитичните и некаталитичните процеси, и двата от които се подчиняват на законите на химическата кинетика, и в двата случая системата от реагиращи вещества преминава през някакво специално активно състояние, специфични особености се наблюдават при хетерогенни каталитични реакции. На първо място се появява твърдо тяло, от свойствата на което по същество зависят всички явления като цяло. Следователно не е случайно, че напредъкът в теорията на хетерогенната катализа е неразривно свързан с развитието на теорията за твърдите тела. Тъй като процесът протича на повърхността, познаването на структурата на повърхността на катализатора е решаващо за развитието на теорията на катализа. От това следва тясна връзка между развитието на теорията на катализа и развитието на експерименталното и теоретично изследване на адсорбционните явления. Сложността на хетерогенните процеси и присъщата им специфичност водят до факта, че теоретичните изследвания в тази област все още не са завършени. Досега можем да говорим за съществуването на няколко теоретични концепции, които в първо приближение обобщават определени експериментални факти.
На практика най-често се срещат два вида хетерогенна катализа:
1) процеси, чийто катализатор е в твърда фаза, а реагентите са в течна фаза;
2) процеси, чийто катализатор е в твърда фаза, а реагентите са в газова фаза. Реакцията, като правило, протича (и в някои многоетапни процеси започва) на границата на фазите, т.е. на повърхността на твърдо тяло - катализатор.
Хетерогенният процес може да бъде разделен на пет етапа:
1) транспортиране на реагенти до повърхността на катализатора (дифузия);
2) адсорбция на реагенти върху повърхността на катализатора;
3) реакция на повърхността;
4) десорбция на реакционните продукти с освобождаване на повърхността на катализатора;
5) транспортиране на реакционните продукти в обема (дифузия).
В зависимост от условията на процеса и неговите характеристики, всеки от петте етапа може да бъде най-бавният и следователно скоростта на каталитичния процес може да бъде ограничена от всеки от тях. За сравнителна оценка на активността на катализаторите определящият фактор е скоростта на реакцията на повърхността. Следователно, в случаите, когато е важно да се получи стойността на активността на катализатора, те се опитват да проведат процеса по такъв начин, че скоростта да се определя от втория, така нареченият кинетичен етап.
Адсорбцията и десорбцията имат свои собствени закони.Адсорбцията е процес на спонтанна промяна в концентрацията на вещество на границата. Веществото, върху чиято повърхност се извършва адсорбция, се нарича адсорбент. Адсорбентът се нарича адсорбат. При хетерогенна катализа адсорбентът е катализатор, а адсорбатът е молекулата на реагента (субстрата). Адсорбцията на субстрата върху катализатора може да се извърши поради силите на взаимодействие, възникващи между молекулите (атомите) на катализатора, разположени на повърхността, и молекулите на субстрата (физическа адсорбция). Може да възникне химично взаимодействие (химическа адсорбция или хемосорбция) между молекулите (атомите) на катализатора и молекулите на реагента. В резултат на адсорбцията подреждането на системата се увеличава, енергията на системата намалява и енергията на активиране на реакцията намалява.
За хетерогенни процеси движението на вещество от вътрешния обем на течност или газ към твърда повърхност е от особено значение. Процесите на масов трансфер се подчиняват на законите на дифузията.
Заключение
Значението на катализаторите и каталитичните процеси в нефтопреработката и нефтохимията не може да бъде надценено. В крайна сметка те са в основата на техническия прогрес в най-важните области за задоволяване на нуждите на съвременното човешко общество. Въпросът е на първо място, че петролът от различни полета обикновено съдържа само 5 до 20% леко кипящи фракции, съответстващи на бензина. Нуждата от бензин с модерното развитие на автомобилния и въздушния транспорт е огромна. В същото време моторните горива, дестилирани директно от нефт, обикновено се оказват с лошо качество. Използването на каталитичен крекинг и реформинг в комбинация с други съвременни методи на преработка позволява да се увеличи добива на високоактивни бензини до 75% от теглото на маслото. Моторните горива се получават и чрез каталитично хидрогениране на въглища с използване на метални катализатори.
По-нататъшната каталитична обработка на въглеводороди върху метални и оксидни катализатори прави възможно получаването на междинни продукти, необходими при производството на потребителски стоки. Повечето мономери и полимери, получени от тях, са продукти на каталитични процеси за преработка на въглеводороди и техните производни, получени от нефт, въглища, шисти и природен газ. Каталитичните процеси играят важна роля в производството на детергенти, багрила за лечебни вещества.
Основният органичен синтез, даващ междинни продукти (и продукти на органичната технология), се основава главно на каталитични реакции. От голямо значение в живота на съвременното общество са продуктите на химическата промишленост като сярна киселина, амоняк и азотна киселина. Почти всички отрасли на националната икономика консумират тези вещества или други химически съединения, получени с тяхна помощ. На тяхна основа се произвеждат десетки милиони тонове минерални торове, без които е невъзможно да се увеличи или дори да се поддържа добивът на нивите. Стотици индустрии в химическата, нефтохимическата, хранителната, леката и други индустрии използват сярна, азотна киселини, амоняк и техните производни. Тези съединения се използват и в металургичната и металообработващата промишленост.
Междувременно мащабното производство на сярна киселина, амоняк и азотна киселина от амоняк стана възможно само благодарение на откриването на подходящи катализатори и разработването на методи за тяхното използване.
Списък на използваните източници
1) A.P. Беляев. Физическа и колоидна химия. М.: ГОЕТАР-Медиа, 2008
2) I.P. Мухленов. Катализаторна технология. М.: Bookinist, 2007
3) Химическа енциклопедия. -- М.: Съветска енциклопедия, 1990 г.
4) Имянитов Н.С. Системи от няколко катализатора в катализа на метални комплекси. // Координационна химия. 1984 г.
Подобни документи
Същност и особености на процеса на катализа на метални комплекси. Свойства на металните комплекси, които определят каталитичната активност. Моделиране на ензимна катализа. Приложения, предимства и недостатъци на катализа с метални комплекси.
отчет, добавен на 16.03.2015
Общи теории на хомогенната катализа. Етапи на катализния процес и скорост на реакцията. Кинетика на каталитичната реакция на диспропорциониране на водороден пероксид в присъствието на различни количества Fe2+ катализатор, ефектът на рН върху скоростта на реакцията.
тест, добавен на 18.09.2012
Определяне на скоростта на химическа реакция. История на откриването, концепция и видове каталитични реакции. Мнения на видни дейци на химията за феномена катализа, неговите физични и химични аспекти. Механизмът на хетерогенната катализа. Ензимна катализа в биохимията.
резюме, добавено на 14.11.2010 г
Понятията за катализа, катализатор и каталитичен процес, техните различни дефиниции. Механизми за ускоряване на реакциите от катализатори. Химична (небиологична) катализа. Синтез на диетилов етер от алкохол с участието на сярна киселина. Теории на катализа.
резюме, добавен на 26.01.2009
Метални катализатори, смесени и полифункционални катализатори на хетерогенна катализа. Изисквания за катализатор. Теории за хетерогенна катализа. Мултиплекс и електронна теория. Теория на активните ансамбли. Катализа при преработка на природен газ.
курсова работа, добавена на 06.05.2014
Определение на катализа и неговата роля в индустрията. Селективност и общи представи за понятието "механизъм на химичната реакция". Класификация на каталитичните системи по фази и видове реакции. Адсорбция и основни изисквания за промишлени катализатори.
резюме, добавен на 26.01.2009
Методи за варене на арендиазониевите соли. Анализ на термодинамичната киселинност на фенолите. Характеризиране на фенол ацилиране, киселинна катализа и феноксиоцетна киселина. Характеристики на реакцията на Колбе-Шмит, метод за получаване на феноксиоцетна киселина.
тест, добавен на 28.03.2012
Предмет на термохимията, изследване на топлинните ефекти на химичните реакции. Видове процеси на химическа кинетика и катализа. Енталпия (термичен ефект) на реакцията. Скорост на реакцията, закон на масовото действие. Константа на химическо равновесие, ефект на катализатор.
презентация, добавена на 19.10.2014
Ензимите (ензимите) са биологични катализатори, използвани при производството на млечнокисели продукти. Международни правила за номенклатурата на ензимите. Ензимите могат да бъдат само глобуларни протеини. Нива на протеиновата структура. Кинетика на ензимната катализа.
резюме, добавен на 26.01.2009
Концепцията за биологични катализатори, действието на ензимите в живите системи и тяхната класификация. Фактори, влияещи върху активността на биологичните катализатори. Вещества, наречени коензими. Кинетика на ензимната катализа, уравнение на Михаелис-Ментен.