Til nå har vi brukt ideen om molekyler som veldig små elastiske kuler, hvis gjennomsnittlige kinetiske energi ble antatt å være lik den gjennomsnittlige kinetiske energien til translasjonsbevegelse (se formel 6.7). Denne ideen om et molekyl er bare gyldig for monoatomiske gasser. Når det gjelder polyatomiske gasser, er bidraget til den kinetiske energien også gitt av rotasjons- og, ved høye temperaturer, vibrasjonsbevegelser til molekylene.
For å estimere hvilken brøkdel av molekylets energi som utgjøres av hver av disse bevegelsene, introduserer vi konseptet grader av frihet. Antall frihetsgrader til en kropp (i dette tilfellet molekyler) forstås som antall uavhengige koordinater, som helt bestemmer kroppens posisjon i rommet. Vi angir antall frihetsgrader til et molekyl med bokstaven i.
Hvis molekylet er monoatomisk (inerte gasser He, Ne, Ar, etc.), så kan molekylet betraktes som et materialpunkt. Siden posisjonen til materialet bestemmes av tre koordinater x, y, z (fig. 6.2, a), har et monoatomisk molekyl tre frihetsgrader for translasjonsbevegelse (i = 3).

Et diatomisk gassmolekyl (H 2 , N 2 , O 2 ) kan representeres som en samling av to stivt sammenkoblede materialpunkter - atomer (Fig. 6.2, b). For å bestemme posisjonen til et diatomisk molekyl er ikke lineære koordinater x, y, z nok, siden molekylet kan rotere rundt koordinatenes sentrum. Det er åpenbart at et slikt molekyl har fem frihetsgrader (i=5): - tre - translasjonsbevegelse og to - rotasjon rundt koordinataksene (av de tre vinklene 1, 2, 3 er bare to uavhengige) .
Hvis et molekyl består av tre eller flere atomer som ikke ligger på samme rette linje (CO 2 , NH 3), så har det (fig. 6.2, c) seks frihetsgrader (i = 6): tre - translasjonsbevegelse og tre - rotasjon rundt koordinataksene.
Det ble vist ovenfor (se formel 6.7) at gjennomsnittlig kinetisk energi  translasjonsbevegelse av et ideelt gassmolekyl, tatt som materialepunkt, lik 3/2kT. Deretter, per en grad av frihet for translasjonsbevegelse, er det en energi lik 1/2kT. Denne konklusjonen i statistisk fysikk er generalisert i form av Boltzmanns lov om jevn fordeling av molekylær energi på tvers av frihetsgrader: statistisk, i gjennomsnitt, har enhver frihetsgrad av molekyler samme energi, ε i, lik:
translasjonsbevegelse av et ideelt gassmolekyl, tatt som materialepunkt, lik 3/2kT. Deretter, per en grad av frihet for translasjonsbevegelse, er det en energi lik 1/2kT. Denne konklusjonen i statistisk fysikk er generalisert i form av Boltzmanns lov om jevn fordeling av molekylær energi på tvers av frihetsgrader: statistisk, i gjennomsnitt, har enhver frihetsgrad av molekyler samme energi, ε i, lik:
Altså den totale gjennomsnittlige kinetiske energien til et molekyl
 (6.12)
(6.12)
I virkeligheten kan molekyler også utføre vibrasjonsbevegelser, og vibrasjonsgraden av frihet står i gjennomsnitt for dobbelt så mye energi som den translasjons- eller rotasjonsmessige, dvs. kT. I tillegg, når vi vurderte den ideelle gassmodellen, tok vi per definisjon ikke hensyn til den potensielle energien til interaksjon mellom molekyler.
Gjennomsnittlig antall kollisjoner og gjennomsnittlig fri bane for molekyler
Det er praktisk å karakterisere prosessen med kollisjon av molekyler ved verdien av den effektive diameteren til molekylene d, som forstås som minimumsavstanden som sentrene til to molekyler kan nærme seg med.
Den gjennomsnittlige avstanden et molekyl reiser mellom to påfølgende kollisjoner kalles betyr fri vei molekyler  .
.
På grunn av tilfeldigheten til termisk bevegelse, er banen til et molekyl en brutt linje, hvis bruddpunkt tilsvarer punktene for dets kollisjoner med andre molekyler (fig. 6.3). På ett sekund reiser et molekyl en bane lik den aritmetiske gjennomsnittshastigheten  . Hvis
. Hvis  - gjennomsnittlig antall kollisjoner på 1 sekund, deretter den gjennomsnittlige frie banen til et molekyl mellom to påfølgende kollisjoner
- gjennomsnittlig antall kollisjoner på 1 sekund, deretter den gjennomsnittlige frie banen til et molekyl mellom to påfølgende kollisjoner
 =
= /
/ (6.13)
(6.13)
For å bestemme  La oss forestille oss molekylet som en kule med diameter d (andre molekyler vil bli ansett som ubevegelige). Lengden på veien som molekylet har tilbakelagt på 1 s vil være lik
La oss forestille oss molekylet som en kule med diameter d (andre molekyler vil bli ansett som ubevegelige). Lengden på veien som molekylet har tilbakelagt på 1 s vil være lik  . Et molekyl på denne banen vil kun kollidere med de molekylene hvis sentre ligger inne i en ødelagt sylinder med radius d (fig. 6.3). Dette er molekylene A, B, C.
. Et molekyl på denne banen vil kun kollidere med de molekylene hvis sentre ligger inne i en ødelagt sylinder med radius d (fig. 6.3). Dette er molekylene A, B, C.

Gjennomsnittlig antall kollisjoner på 1 s vil være lik antall molekyler i denne sylinderen:
 =n 0 V,
=n 0 V,
hvor n 0 er konsentrasjonen av molekyler;
V er volumet til sylinderen, lik:
V = πd 2 
Altså gjennomsnittlig antall kollisjoner
 = n 0 π
= n 0 π  d 2
d 2
Når man tar hensyn til bevegelsen til andre molekyler mer nøyaktig
 =
=
 πd 2 n 0
πd 2 n 0  (6.14)
(6.14)
Da er den gjennomsnittlige ledige banen i henhold til (6.13) lik:
 (6.15)
(6.15)
Dermed avhenger den gjennomsnittlige frie banen bare av den effektive diameteren til molekylet d og deres konsentrasjon n 0 . La oss for eksempel anslå  Og
Og  . La d~10 -10 m,
. La d~10 -10 m,  ~500 m/s,n 0 = 3·10 25 m -3, da
~500 m/s,n 0 = 3·10 25 m -3, da  3·10 9 s –1 og
3·10 9 s –1 og  7 ·10 - 8 m ved et trykk på ~10 5 Pa. Når trykket synker (se formel 6.8)
7 ·10 - 8 m ved et trykk på ~10 5 Pa. Når trykket synker (se formel 6.8)  øker og når en størrelse på flere titalls meter.
øker og når en størrelse på flere titalls meter.
1) Frihetsgrader- egenskaper ved bevegelsen til det mekaniske systemet. Antall frihetsgrader bestemmer minimumsantallet uavhengige variabler (generaliserte koordinater) som er nødvendige for å fullstendig beskrive bevegelsen til et mekanisk system. Dessuten er antall frihetsgrader lik det totale antallet uavhengige ligninger som fullstendig beskriver dynamikken i systemet.
De aller fleste fysiske systemer kan være i ikke én, men mange tilstander, beskrevet av både kontinuerlige (for eksempel koordinatene til en kropp) og diskrete (for eksempel kvantetallene til et elektron i et atom) variabler. Uavhengige "retninger", variabler som karakteriserer systemets tilstander, kalles grader av frihet.
2)Antall frihetsgrader- det minste antallet parametere som må stilles inn for å tydelig bestemme posisjonen til kroppen i rommet. betegnet med i.
Minimumsverdien jeg kan ta er 3.
fordi tre koordinater x, y, z. Dette betyr at materialpunktet bare beveger seg gradvis.
Men hvis en kropp eller et molekyl roterer, blir hver rotasjonsbevegelse tildelt en annen grad av frihet.
Ved diatomisk gass i=5.
fordi molekylet kan rotere i to vinkelrette plan.
For triatomisk gass i=6.
fordi molekylet er i stand til å rotere i tre innbyrdes vinkelrette plan.
Når temperaturen øker, begynner atomene i molekylene å vibrere. Hver oscillerende bevegelse er tildelt to frihetsgrader. Den ene tilsvarer kinetisk energi, den andre til potensiell interaksjonsenergi. Derfor, med økende temperatur, øker antallet frihetsgrader for 2 eller flere atommolekyler.
M er en vilkårlig gassmasse.
N er antall partikler.
Intern energi til ett molekyl
Multipliser med antall molekyler for å få energien til hele gassen
U - indre energi ![]()
hvis det er 1 mol gass ![]()
Hvis gass (nu) mol ![]()
eller
Denne energien kalles den indre energien til en ideell gass.
Generelt er den indre energien til en kropp den totale energien knyttet til selve molekylene, dvs. deres "usynlige" energi. Dette inkluderer den kinetiske energien til bevegelsen til selve molekylene, den kinetiske energien til bevegelsen av atomer inne i molekylet (hvis molekylet ikke er monoatomisk), den potensielle energien for interaksjon mellom atomer inne i molekylet, og til og med den kinetiske energien til partiklene som utgjør atomene (kjerner og elektroner). Det inkluderer imidlertid ikke den kinetiske energien som en gass kan ha hvis den som helhet beveger seg, og den potensielle energien den kan ha hvis den er i feltet til noen krefter. Den indre energien til en gitt masse av en ideell gass avhenger, som man kan se av formlene, kun av temperatur og er ikke avhengig av verken trykk eller volum av gassen. (Dette er ikke sant for ikke-ideelle gasser.)
Fra formlene ovenfor er det klart at for å endre temperaturen på en gass, må du endre dens indre energi. En endring i energi, som kjent fra mekanikk, er assosiert med arbeid: energien til en kropp endres hvis kroppen gjør arbeid eller arbeid utføres på kroppen, og denne endringen er nøyaktig lik arbeidet som gjøres.
Herfra ser det ut til å følge at en endring i temperaturen til en gass eller et hvilket som helst legeme generelt bare kan oppnås gjennom mekanisk arbeid: for å varme opp et legeme må det arbeides på det, og for å avkjøle er det nødvendig å skape forhold under som den selv kan gjøre. Erfaring viser at kroppstemperaturen faktisk kan endres ved bruk av passende mekanisk arbeid. For eksempel, når kropper gni mot hverandre, varmes de opp (den eldste metoden for å lage ild er basert på dette). Som det vil vises nedenfor, kan gass også varmes opp ved å utføre arbeid.
En viktig egenskap ved et termodynamisk system er dets indre energi. Som kjent består energien til et legeme av den kinetiske energien til kroppens bevegelse med hastighet v og den potensielle energien til kroppen i ytre kraftfelt (gravitasjons-, magnetisk, etc.):
E pels =(1/2) mv 2 +E svette.
I følge MCT består alle legemer av molekyler som er i en tilstand av kontinuerlig, kaotisk bevegelse, det vil si at de har kinetisk energi, og på grunn av interaksjon med hverandre har de potensiell interaksjonsenergi.
Intern energi er den totale energien til den kaotiske (termiske) bevegelsen av mikropartikler i systemet og energien til interaksjonen til disse partiklene.
Intern energi er en entydig funksjon av den termodynamiske tilstanden til systemet (når et system går over fra en tilstand til en annen, bestemmes endringen i intern energi av forskjellen i verdiene til den indre energien til disse tilstandene og er ikke avhengig av på overgangsveien).
Som kjent fra mekanikken skjer bevegelse av kropper (eller materielle punkter) i rom og tid. Enhver bevegelse av kroppen kan representeres som en kombinasjon av translasjons- og rotasjonsbevegelser. Kroppens stilling i hvert øyeblikk er preget av antall frihetsgrader.
Antall frihetsgrader til et molekyl er antall uavhengige variabler (koordinater) som fullstendig bestemmer posisjonen til systemet i rommet.
Et molekyl av en monoatomisk gass (på grunn av sin litenhet) kan betraktes som et materiell punkt, som tre grader av frihet for translasjonsbevegelse tilskrives: i=i post (fig. 8).
Ris. 8. For å bestemme antall frihetsgrader for et monoatomisk molekyl
Den gjennomsnittlige kinetiske energien til translasjonsbevegelsen til et monoatomisk molekyl av en ideell gass er lik:
E 0 = m 0 (v sq) 2/2 = 3kT/2.
Rotasjonsfrihetsgrader i dette tilfellet tas ikke i betraktning, siden treghetsmomentet til et gitt molekyl i forhold til hver av aksene: I x =mr 2, I y =mr 2, I z =mr 2, avstanden til rotasjonsaksene er r→0, derfor I x → 0, I y →0, I z →0, deretter den kinetiske rotasjonsenergien for hver av aksene:
E tid =Iω2 →0.
Et diatomisk gassmolekyl betraktes som et sett av to materialpunkter som er stivt forbundet med en ikke-deformerbar binding (fig. 9). I tillegg til tre translasjonsfrihetsgrader, har et slikt molekyl to rotasjonsfrihetsgrader:

Ris. 9. For å bestemme antall frihetsgrader for et diatomisk molekyl
i=i post +i rotasjon =5
Triatomiske og polyatomiske ikke-lineære molekyler har seks frihetsgrader: tre translasjonsgrader og tre rotasjonsgrader (fig. 10):

Ris. 10. For å bestemme antall frihetsgrader for et triatomisk molekyl
i=i post +i rotasjon =6
Faktisk er det ingen stiv forbindelse mellom atomer. Atomer i et molekyl kan bevege seg nærmere og lenger fra hverandre, det vil si at de kan vibrere rundt en likevektsposisjon. Energien til vibrasjonsbevegelsen til et molekyl er summen av kinetiske og potensielle energier, hvis gjennomsnittsverdier er de samme. For ekte molekyler er det derfor også nødvendig å ta hensyn til graden av frihet for vibrasjonsbevegelse.
I klassisk statistisk fysikk er Boltzmanns lov om ensartet fordeling av energi over molekylers frihetsgrader utledet: for et statistisk system i en tilstand av termodynamisk likevekt er det for hver translasjons- og rotasjonsfrihetsgrad en gjennomsnittlig kinetisk energi lik. kT/2, og for hver vibrasjonsgrad av frihet – i gjennomsnitt er energien lik. Den gjennomsnittlige energien til et molekyl er:
(ε)=·kT, (46)
Hvor i=i post +i rotasjon +2i oscillasjon
Det har blitt fastslått at energien til translasjons- og rotasjonsbevegelsen til molekylet er mye mindre enn energien til vibrasjonsbevegelsen til atomene i molekylet, derfor eksiteres vibrasjonsfrihetsgrader ved høye temperaturer.
Den indre energien til en ideell gass består kun av kinetiske energier til alle molekyler i et gitt volum, siden den potensielle energien for interaksjon mellom molekyler, i henhold til antakelsene til den ideelle gassmodellen (avsnitt 1.3), kan neglisjeres.
For én mol ideell gass:
U m =EN A =·kN A T
Intern energi for en vilkårlig masse av en ideell gass:
For å forstå sammenhengen mellom temperatur og intern energi, la oss gjenta konseptet introdusert tidligere i mekanikk - antall frihetsgrader.
I § 1.3 ble det vist at press gass er numerisk lik impuls, som overføres per tidsenhet til en enhetsareal av veggen som et resultat av påvirkning av molekyler på den, derfor bestemmes trykket kun av gjennomsnittlig energi progressive molekylære bevegelser.
Foroverbevegelsen til ethvert system "som helhet" er fullstendig bestemt av bevegelsen til ett enkelt punkt: dets massesenter. Spesielt er det totale momentumet til ethvert ikke-relativistisk system lik produktet av massen til dette systemet og bevegelseshastigheten til dets massesenter. Energien til translasjonsbevegelse av systemet "som helhet" er lik ![]() . Derfor, for en fullstendig beskrivelse av translasjonsbevegelsen til ethvert system i tredimensjonale plass er det nødvendig og tilstrekkelig til å spesifisere verdier tre koordinater til massesenteret. Dermed tilsvarer translasjonsbevegelse, uansett hvordan systemet er strukturert, alltid tre translasjonsgrader av frihet: .
. Derfor, for en fullstendig beskrivelse av translasjonsbevegelsen til ethvert system i tredimensjonale plass er det nødvendig og tilstrekkelig til å spesifisere verdier tre koordinater til massesenteret. Dermed tilsvarer translasjonsbevegelse, uansett hvordan systemet er strukturert, alltid tre translasjonsgrader av frihet: .
Vi kan si dette: "fra translasjonsbevegelsens synspunkt," kan ethvert system representeres nøyaktig, og ikke tilnærmet, i form av ett enkelt materialpunkt som sammenfaller med systemets massesenter og har en masse lik massen til systemet (fig. 1.15).

Ris. 1.15. Monatomisk molekyl
Hvis vi snakker om den totale indre energien til gassen U, så består den, generelt sett, av mange komponenter som tilsvarer alle mulige typer bevegelse i et molekyl og energien til interaksjon av molekyler med hverandre. Når man vurderer en ideell gass, blir interaksjonsenergien til molekyler neglisjert.
La oss først vurdere en edelgass, for eksempel helium. Faktum er at alle edelgasser er monoatomiske, hvorav helium er den letteste og følgelig har den enkleste strukturen. Et heliumatom (som betyr hovedisotopen) er en positivt ladet kjerne med 2 protoner og 2 nøytroner og et elektronskall med 2 negativt ladede elektroner. Totalt 6 partikler, hvis hver av dem regnes som et materiell punkt, er dette 18 frihetsgrader. Men ikke alt er så deprimerende dystert, kvantemekanikk hjelper til. Uten å gå inn på "kvante" detaljer, påpeker vi at for å endre tilstanden til elektronskallet til heliumatomet, nemlig: å overføre det fra grunntilstanden med minst mulig energi til en eksitert tilstand med høy energi, er nødvendig minimum energi ca. 20 eV. Mer presist, for eksempel, når elektronskallet til et heliumatom er eksitert, er en overgang som krever 19,8198 eV mulig. Energispekteret til atomer er diskret: det er lett å akseptere et heliumatom med lavere energi kan ikke, det er slik han er designet. Når et heliumatom kolliderer med et elektron med lavere energi, vil heliumatomet forbli i den opprinnelige grunntilstanden med lavest mulig indre energi, hvis verdi bare avhenger av valget av energireferansepunktet, og som oftest, er ganske enkelt tatt lik null. En slik kollisjon vil være absolutt elastisk. Noter det
Derfor tilsvarer en energi på 20 eV en temperatur i størrelsesorden kelvin. Det er sannsynligvis ikke vanskelig å forstå at selv ved en temperatur på K vil heliumatomer som beveger seg så raskt at energien til deres relative bevegelse er 100 ganger større enn gjennomsnittsverdien være ubetydelig. Men da vil kollisjoner ledsaget av en endring i den indre energien til et av de kolliderende atomene være ekstremt sjeldne, derfor kan den mulige tilstedeværelsen av atomer med et eksitert elektronskall neglisjeres, og det kan omtrent antas at alle atomer har et elektronskall i samme grunntilstand med minst mulig energi. Det er ikke så viktig at elektronskallene til alle atomer har minst mulig energi, da det er viktig at det samme i alle atomer og endres ikke selv når gassen er veldig varm. Da er den totale energien til elektronskallene til alle atomer ganske enkelt en konstant lik , hvor N er antall atomer i gassen, og er energien til elektronskallet til hvert atom. For et fast totalt antall atomer denne verdien avhenger ikke av noen parametere for gassens tilstand. Det gjenstår å huske nok en gang at energi alltid bestemmes opp til en additiv konstant og kast bort denne konstanten, og endrer opprinnelsen til energi.
For å endre tilstanden til atomkjerner, kreves det energi på hundretusenvis av eV, som er uhyrlig høyt "på gassskalaer." Tilsvarende temperaturer observeres bare i de indre områdene av stjerner. Derfor muligheten for å endre den interne tilstanden kjerner under kollisjoner i gass det er ikke nødvendig å si (dette refererer til stabile kjerner; mulig forfall av ustabile kjerner har ingenting å gjøre med parametrene for gassens tilstand).
Det som er igjen? Det som gjenstår er translasjonsbevegelsen til atomet som helhet, det vil si tre translasjonsgrader av frihet. Dette rettferdiggjør bruken av denne modellen:
Bare i tilfelle, la oss ta forbehold om at vi for øyeblikket ikke er interessert i prosessene for å etablere termodynamisk likevekt i en gass. Likevekt etableres nøyaktig som et resultat av samspillet mellom gasspartikler under deres kollisjoner, derfor beskriver ikke "atom - material point"-modellen slike prosesser.
Posisjonen med elektronskallet endres ikke hvis atomene er en del av et polyatomisk molekyl. Minimumsenergien som kreves for å endre tilstanden (eksitasjonen) til elektronskallet til molekyler er omtrent den samme som for eksitasjon av elektronskallene til atomer. Figuren som er karakteristisk for den atom-molekylære verden er omtrent 10 eV, som tilsvarer en temperatur på omtrent hundretusenvis av kelvin. Ved slike temperaturer er ikke gassen lenger en gass, men et lavtemperaturplasma. Derfor, mens en gass forblir en gass, kan vi i det overveldende flertallet av tilfellene anta med utmerket nøyaktighet at elektronskallene til alle gassmolekyler er i samme tilstand, deres totale energi er konstant uavhengig av gasstilstandsparametere, som kan utelates. Selvfølgelig er det unntak som krever litt forsiktighet. For eksempel har oksygenmolekylet - etter atom-molekylære standarder - en svært langvarig eksitert tilstand, som dette molekylet krever kun 0,982 eV til. Det er i denne tilstanden at oksygenmolekylet er ekstremt kjemisk aktivt, dette er et veldig viktig unntak og interessant i konsekvensene, men et unntak som absolutt må tas i betraktning i relevante problemer, for eksempel ved beregning av kjemiske reaksjonshastigheter involverer dette molekylet.
Således, selv i sammensetningen av et molekyl, kan et atom betraktes som et materiell punkt.
La oss fokusere separat på å beregne antall rotasjons- og vibrasjonsgrader av frihet for polyatomiske molekyler. La oss starte med å vurdere rotasjonsgradene av frihet til et diatomisk molekyl. Alle diatomiske molekyler er lineære av den enkle grunn at to divergerende punkter definerer en rett linje, med andre ord, to punkter ligger alltid på samme rette linje (Fig. 1.16). Det finnes også mer komplekse, men lineære molekyler, for eksempel er karbondioksidmolekylet lineært: i grunntilstanden (med lavest mulig energi) ligger alle tre atomene på samme rette linje.

Ris. 1.16. Diatomisk molekyl
Vanligvis, når man beregner den indre energien til en gass, tas rotasjonen til et lineært molekyl kun i betraktning rundt dets to hovedakser, som går gjennom massesenteret og vinkelrett på molekylets akse; rotasjonen av molekylet rundt dets symmetriakse vurderes ikke, noe som er helt riktig. Men på dette grunnlaget heter det at et lineært molekyl kun har 2 rotasjonsfrihetsgrader, noe som er kategorisk feil. Vi vil imidlertid fortsette å skrive på denne måten, noe som selvfølgelig krever forklaring. Det faktum at det kun er to rotasjonsgrader av frihet er åpenbart feil av følgende grunn. Et lineært molekyl er en romlig formasjon som har endelige dimensjoner i alle tre dimensjonene. For eksempel er avstanden mellom kjerner i et molekyl meter, og gassens kinetiske radius (radius i modellen: molekyl - ball) er lik meter. Radiene til nitrogenkjerner er i størrelsesorden en meter. Med tanke på det, oppstår et legitimt spørsmål: "Hvorfor skulle den ikke også rotere rundt sin egen akse?" Kvantemekanikken har igjen skylden. Kvantemekaniske beregninger viser at energien som kreves for å indusere rotasjon rundt en bestemt akse er omvendt proporsjonal treghetsmoment i forhold til denne aksen. Derfor snakker vi ikke om spennende rotasjon av kjerner - radiusen til disse "kulene" er for liten, og følgelig er minimumsenergien som kreves for å bringe dem i rotasjonsbevegelse for stor. Dette er igjen hundrevis av kiloelektronvolt: de såkalte rotasjonsenerginivåene til kjerner. Det er bare én ting igjen: å "vikle" elektronskallet rundt molekylets akse, men enhver endring i tilstanden til elektronskallet krever energi i størrelsesorden 10 eV. Nærmere bestemt, for å "vri" et molekyl rundt sin akse, det vil si å overføre molekylet til den første rotasjonseksiterte tilstanden, kreves det 7,35 eV, som tilsvarer en temperatur som overstiger sytti tusen grader. Således, ved "gass"-temperaturer, det vil si ved de temperaturene når gassen fortsatt er en gass og ikke et plasma (mindre enn flere tusen grader), vil antallet lineære molekyler som roterer rundt sin egen akse være ubetydelig.

Ris. 1.17. Lineært molekyl
Den generelle situasjonen er denne. Tilsynelatende fravær et molekyl har visse frihetsgrader på grunn av det faktum at energien som kreves for å begeistre de tilsvarende bevegelsestypene, på grunn av kvanteårsaker, for mye flott(ikke liten!, Fig. 1.17). Molekyler der disse bevegelsestypene eksiteres som et resultat av kollisjoner av molekyler med hverandre, er enten ikke tilstede i det hele tatt (i rimelige mengder gass), eller de er tilstede, men i så liten relativ mengde at bidraget til den indre energien til gassen i disse bevegelsestypene er ubetydelig. Dette gjelder alle de frihetsgradene som er assosiert med elektronene i elektronskallet til molekylet. Det er av denne grunn at både et isolert atom og et atom i et molekyl kan betraktes som et materialpunkt (fig. 1.18).

Ris. 1.18. Triatomisk molekyl
I lys av det ovennevnte, bestemmer antallet frihetsgrader for et molekyl innenfor rammen av modellen: "atom - materialpunkt" kommer ned til følgende.
Hvis et molekyl består av atomer - materielle punkter, frihetsgrader:
Total- , av dem:
progressive- 3 alltid,
roterende- 3 (romlig molekyl) eller 2 (lineært molekyl),
oscillerende- eller for romlige (lineære) molekyler.
Vi anbefaler på det sterkeste at du teller frihetsgradene i denne rekkefølgen: alle translasjons-, rotasjons- og det som gjenstår er oscillerende. Du bør ikke stole på strukturelle kjemiske formler; de viser kjemiske bindinger, og ikke mulighetene for visse vibrasjonsbevegelser av grupper av kjerner eller individuelle kjerner av atomene som utgjør molekylet. For eksempel reflekteres ikke muligheten for torsjonsvibrasjoner på noen måte. Bruken av disse formlene fører oftest til feil ved beregning av antall vibrasjonsfrihetsgrader. Det er bare én ting du trenger å vite om strukturen til et molekyl: om det er lineært eller ikke.
La oss gi tre eksempler på beregning av antall frihetsgrader for molekyler ![]() . La oss først introdusere et "klassisk tall", som vi betegner som , det vil være nødvendig senere:
. La oss først introdusere et "klassisk tall", som vi betegner som , det vil være nødvendig senere:
her er antall translasjonelle frihetsgrader, antall rotasjonsfrihetsgrader og antall vibrasjonsfrihetsgrader. På grunn av de to foran er ikke dette tallet lik det totale antallet frihetsgrader til molekylet og bør ikke kalles det.
Tabell 1.4.1.
|
Molekyl / grader frihet; |
lineær |
lineær |
flat eller romlig |
|
|
Progressiv |
||||
|
Roterende |
||||
|
Oscillerende |
||||
Etanmolekylet har to likevektskonfigurasjoner: i ett tilfelle ligger alle åtte atomer i ett plan; i det andre likevektskonfigurasjonen er planene der de fire "venstre" og de "høyre" fire ligger vinkelrett på hverandre. I begge likevektskonfigurasjoner er torsjonsvibrasjoner av disse planene med atomer nær deres likevektsposisjoner mulige. Vibrasjoner av atomer, eller rettere sagt kjernene til atomer som er en del av et polyatomisk molekyl, er intern bevegelse i molekylet, derfor er det mest praktisk å vurdere denne bevegelsen i systemet til molekylets massesenter.
For å forstå hvorfor et triatomisk vannmolekyl har tre vibrasjonsgrader av frihet, og et triatomisk karbondioksidmolekyl har fire, la oss vurdere de naturlige vibrasjonsmodusene til kjernene i molekylet .
De fire vibrasjonsmodusene til dette molekylet er som følger. Symmetrisk mote: alle tre kjernene forblir på samme rette linje, karbonkjernen er ubevegelig, de to oksygenkjernene vibrerer i motfase, det vil si at de i halve perioden nærmer seg hverandre og karbonkjernen, beveger seg mot den fra to motsatte sider; den andre halvdelen av perioden beveger de seg, fortsatt i motfase, bort fra hverandre og fra karbonkjernen. Asymmetrisk mote: alle tre kjernene forblir på samme rette linje, to oksygenkjerner, som en enkelt helhet (med konstant avstand mellom dem) vibrerer i motfase med karbonkjernen. Dobbelt degenerert deformasjonsmodus: kjernene holder seg ikke på samme rette linje; i øyeblikket når de forlater likevektsposisjonene som ligger på den rette linjen , de (alle tre) beveger seg i retninger vinkelrett på denne linjen. Hvis, relativt sett, aksen til molekylet er horisontal og karbonkjernen beveger seg oppover, så beveger begge oksygenkjernene seg nedover. Det vil si at to oksygenkjerner vibrerer i fase med hverandre og ut av fase med karbonkjernen. Dette er forståelig: ellers vil ikke massesenteret til molekylet forbli ubevegelig.
To strengt tatt like de naturlige frekvensene til den dobbelt degenererte deformasjonsmodusen tilsvarer bevegelsen til kjerner i to innbyrdes vinkelrette plan. Hvis vibrasjoner av bare én av de to deformasjonsmodusene blir eksitert, forblir alle tre kjernene i et plan fiksert i rommet. Hvis oscillasjoner eksiteres i begge innbyrdes perpendikulære plan (begge moduser), er banene til alle tre kjernene, som et resultat av tillegg av to gjensidig vinkelrette oscillasjoner med strengt like amplituder, ellipser, og med like amplituder og faseforskyvninger, er sirkler. Dessuten, hvis karbonkjernen beveger seg langs sin ellipse "med klokken", så beveger begge oksygenkjernene seg langs sine identiske ellipser "mot klokken". Ordene "for" og "mot" settes i anførselstegn av en åpenbar grunn: de er betingede, siden de avhenger av hvilken side du ser på.
Dermed tilsvarer de fire vibrasjonsfrihetsgradene til et molekyl kun tre forskjellige frekvenser, siden deformasjonsmodusen er dobbelt degenerert.
Ethvert diatomisk molekyl innenfor rammen av "atom - material point"-modellen har en vibrasjonsgrad av frihet, som tilsvarer en veldig enkel bevegelse: avstanden mellom de to kjernene svinger. Imidlertid har ofte de makroskopiske egenskapene til en diatomisk gass, for eksempel dens varmekapasitet ved konstant volum og trykk, deres forhold - den adiabatiske eksponenten og andre, (med prosentvis nøyaktighet!) de samme verdiene som om disse molekylene ikke hadde det. ha en vibrasjonsgrad av frihet. Vi understreker at denne "hendelsen" skjer for det første ikke for alle molekyler og for det andre bare ved ikke for høye temperaturer, som ikke overstiger flere hundre kelvin. Denne situasjonen oppstår for eksempel for luft (omtrent 80 % nitrogen og 20 % oksygen) ved romtemperatur ![]() . Det er ganske åpenbart at antallet frihetsgrader til et molekyl ikke kan avhenge av parametrene for tilstanden til gassen som det er en del av. Dette tallet bestemmes av tredimensjonaliteten til rommet og modellen: "atom - materialpunkt". Spørsmålet er: "Hva er i veien?"
. Det er ganske åpenbart at antallet frihetsgrader til et molekyl ikke kan avhenge av parametrene for tilstanden til gassen som det er en del av. Dette tallet bestemmes av tredimensjonaliteten til rommet og modellen: "atom - materialpunkt". Spørsmålet er: "Hva er i veien?"
For å eksitere kjernefysiske vibrasjoner i et nitrogenmolekyl, må det gis en energi som ikke er mindre enn et oksygenmolekyl; som de sier i slike tilfeller, er "vibrasjonskvantumet" litt mindre, nemlig: . Forut for selve kvantemekaniske beregningen vil vi rapportere resultatene.
I romtemperatur ![]() andelen vibrasjonseksiterte nitrogenmolekyler av deres totale antall vil være omtrentlig
andelen vibrasjonseksiterte nitrogenmolekyler av deres totale antall vil være omtrentlig 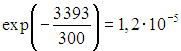 , for oksygen er denne fraksjonen omtrent lik
, for oksygen er denne fraksjonen omtrent lik  . Således vil det i hver kubikkcentimeter luft ved romtemperatur være flere vibrasjonseksiterte nitrogenmolekyler og en størrelsesorden flere vibrasjonseksiterte oksygenmolekyler. Under disse forholdene er det knapt mulig å si at disse molekylene er "stive" og har bare fem frihetsgrader, siden de ikke har en vibrasjonsgrad av frihet. Allerede ved en temperatur på 1000 K vil dessuten andelen av vibrasjonseksiterte molekyler være ca. 3 % for nitrogen og ca. 10 % for oksygen. Som et annet eksempel, la oss se på et molekyl, der en minimumsmengde energi er nødvendig for å eksitere vibrasjoner av kjernene. Allerede ved romtemperatur vil andelen vibrasjonseksiterte molekyler være omtrent 20 %. Vibrasjonene til kjernene i dette molekylet kan ikke neglisjeres selv ved romtemperatur.
. Således vil det i hver kubikkcentimeter luft ved romtemperatur være flere vibrasjonseksiterte nitrogenmolekyler og en størrelsesorden flere vibrasjonseksiterte oksygenmolekyler. Under disse forholdene er det knapt mulig å si at disse molekylene er "stive" og har bare fem frihetsgrader, siden de ikke har en vibrasjonsgrad av frihet. Allerede ved en temperatur på 1000 K vil dessuten andelen av vibrasjonseksiterte molekyler være ca. 3 % for nitrogen og ca. 10 % for oksygen. Som et annet eksempel, la oss se på et molekyl, der en minimumsmengde energi er nødvendig for å eksitere vibrasjoner av kjernene. Allerede ved romtemperatur vil andelen vibrasjonseksiterte molekyler være omtrent 20 %. Vibrasjonene til kjernene i dette molekylet kan ikke neglisjeres selv ved romtemperatur.
Det er neppe rimelig å si at tilstedeværelsen eller fraværet av en vibrasjonsfrihetsgrad i et diatomisk molekyl avhenger av typen molekyl og temperaturen til gassen. Dette er et forsøk på å "dytte" vibrasjonsbevegelsen til kjerner, som er av kvantenatur, inn i rammen av en klassisk (ikke-kvante) beskrivelse som er utilstrekkelig i dette tilfellet. Et diatomisk molekyl har alltid en vibrasjonsgrad av frihet, men bidraget fra vibrasjonsbevegelsen til kjerner i et slikt molekyl til den indre energien til gassen, til varmekapasiteten og til den adiabatiske indeksen og andre egenskaper til gassen kan være ubetydelig dersom ulikheten tilfredsstilles
![]()
hvor er Boltzmann-konstanten introdusert ovenfor. Når den motsatte ulikheten gjelder
Vibrasjonsbevegelsen til kjerner kan ikke neglisjeres. En klassisk (ikke-kvante) beskrivelse av vibrasjonsbevegelsen til kjerner i molekyler er bare mulig i tilfelle av lav eksitasjonsenergi av vibrasjonsbevegelse og en tilstrekkelig høy temperatur, nemlig: når ulikheten
![]() ,
,
som i praksis bare utføres i sjeldne unntakstilfeller som for eksempel et molekyl. I luften som vi kan puste relativt komfortabelt, er vibrasjoner av kjerner i molekyler ikke beskrevet av klassisk mekanikk.
La oss nå gå tilbake til den ideelle gassen. Vi har sett at den gjennomsnittlige kinetiske energien til translasjonsbevegelsen til molekyler er lik
![]()
og at translasjonsbevegelse tilsvarer tre frihetsgrader. Dette betyr at per frihetsgrad, i en tilstand av termodynamisk likevekt, er det en gjennomsnittlig energi
Med en klassisk (ikke kvante) beskrivelse er alle typer bevegelse like. Molekyler kolliderer, og i dette tilfellet kan det lett skje at energien til translasjonsbevegelsen blir til energien til rotasjonsbevegelse. Derfor bør hver av rotasjonsfrihetsgradene ha i gjennomsnitt samme mengde energi -
Denne uttalelsen er kjent som Boltzmanns lov om likefordeling av energi over frihetsgrader. På lignende måte kan kollisjoner av molekyler gi opphav til vibrasjonsbevegelser av kjernene i dem, så den klassiske loven om ekvideling gjelder også for molekylers vibrasjonsfrihetsgrader. Men det er en subtilitet her. Hvis bare kinetisk energi tilsvarer translasjons- og rotasjonsbevegelser, så har en harmonisk oscillator (én vibrasjonsfrihetsgrad) i gjennomsnitt strengt like kinetiske og potensielle energier. Derfor, i gjennomsnitt, i en tilstand av termodynamisk likevekt, under betingelser for anvendelighet av den klassiske beskrivelsen av oscillerende bevegelse, per en vibrasjonsfrihetsgrad er det en energi dobbelt så stor; dette er slett ikke det nominelle antallet vibrasjonsgrader til et polyatomisk molekyl, da vil gjennomsnittsenergien til ett molekyl være lik
vi møtes i neste kapittel, hvor betydningen av dette begrepet blir tydeligere. Som vist ovenfor, blir vibrasjonsbevegelsen til kjerner i molekyler begeistret først når de når tilstrekkelig høye temperaturer ( T > 1000 K), derfor er deres bidrag til den indre energien til gassen for de fleste molekyler ved vanlige (nær rom) temperaturer ubetydelig, vi vil ikke ta hensyn til det, det vil si, med mindre annet er angitt vi vil anta det
![]() ,
,
hvor og er lik det nominelle antallet translasjons- (alltid 3) og rotasjons- (3 eller 2) frihetsgrader, i henhold til strukturen til molekylet.
Eksempel. I et rom med et volum 75 m 3 Det er en diatomisk gass (luft) ved en temperatur t = 12 °C (T = 285 K). Slå på varmeren og øk lufttemperaturen til t2 = 22 °C (T 2 = 295 K). Siden rommet ikke er forseglet, forblir gasstrykket konstant og likt hele tiden 100 kPa. La oss finne endringen i den indre energien til gassen i rommet og bestemme hvor mye energi som ble brukt på å varme opp miljøet.
Svaret er noe uventet: i henhold til (1.19) har den indre energien til gassen i rommet ikke endret seg, siden både trykk og volum forble det samme. På den annen side forlot noe av gassen rommet: hvis den først inneholdt
Siden intern energi er proporsjonal med absolutt temperatur, etter oppvarming av et forseglet rom viser det seg at

det vil si at energi mottas fra ovnen
På det andre trinnet fjerner vi fra rommet 3,39 % oppvarmet luft, og med den samme andel energi. Energi fjernet
nøyaktig lik energien som mottas fra ovnen. På en annen måte kom vi igjen til samme konklusjon.
Så, nå er det endelig klart at luften som slapp ut i gaten tok med seg all energien som ble mottatt fra ovnen. Hva er da ovnens rolle? Var det i det hele tatt verdt å slå den på hvis den bare varmer opp gaten? Den gunstige effekten av ovnen er at ved en temperatur på 12 grader er en persons varmetap til luften rundt så stort (til tross for at han er påkledd, må man anta) at kroppens termoreguleringssystem har vanskeligheter med å holde normal temperatur og signaliserer dette: det er kald person, ubehagelig! Og ved en temperatur på 22 grader er varmetapet betydelig mindre, belastningen på termoreguleringssystemet er mindre - en person føler seg ganske komfortabel og har ikke lyst til å slå på varmeren.
Tilleggsinformasjon
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - J. de Boer Introduksjon til molekylær fysikk og termodynamikk, red. IL, 1962 - s. 50–61, del I, § 6, - teoretisk beregning av varmekapasiteter, eksperimentelle avhengigheter av varmekapasitet ved konstant volum i et bredt temperaturområde for ti spesifikke gasser er gitt.
La oss sammenligne uttrykkene
Termodynamisk temperatur er en verdi proporsjonal med den gjennomsnittlige energien til translasjonsbevegelse av molekyler.
Bare gassmolekyler beveger seg progressivt; bevegelsen av molekyler i flytende og faste legemer er av en annen natur.
Det er viktig at gjennomsnittsenergien til molekyler kun avhenger av temperatur og ikke avhenger av massen til molekylet.
Introduserer ![]() , og sammenligne med
, og sammenligne med ![]() , vi får:
, vi får:
|
|
(43 .3 ) |
Kvadratroten av en mengde kalles rot gjennomsnittlig kvadrathastighet av molekyler. Bare monoatomiske molekyler beveger seg fremover. Di- og polyatomiske molekyler, i tillegg til translasjonsbevegelse, kan også utføre rotasjons- og vibrasjonsbevegelser. Disse bevegelsestypene er assosiert med en viss mengde energi, som kan beregnes av loven om likefordeling av energi over molekylets frihetsgrader etablert av klassisk fysikk (dvs. basert på Newtons lover) og statistisk fysikk.
La oss introdusere begrepet antall frihetsgrader til et mekanisk system.
Antall frihetsgrader til et mekanisk system er antallet uavhengige størrelser ved hjelp av hvilke posisjonen til systemet i rommet kan spesifiseres.
Plasseringen til et materialpunkt i rommet bestemmes av verdiene til dets tre koordinater, for eksempel kartesiske koordinater x, y, z eller sfæriske koordinater r, θ, φ, etc. I samsvar med dette har et vesentlig punkt tre grader av frihet.
Posisjonen til et absolutt stivt legeme (ARB) kan bestemmes ved å bruke x, y, z-koordinatene til dets massesenter og vinklene θ, φ og ψ, som indikerer orienteringen til kroppen i rommet.

Koordinatene til massesenteret C bestemmes i et fast referansesystem x, y, z. Hjelpekoordinataksene x´, y´, z´ beveger seg translasjonsmessig sammen med kroppen. De innbyrdes vinkelrette aksene AA og BB er stivt forbundet med kroppen. Den rette linjen A´A´er projeksjonen av AA-aksen på x´z´-planet. Vinklene φ og υ bestemmer orienteringen i rommet til AA- og A`A`-aksen. Vinkelen θ bestemmer orienteringen til eksplosivaksen.
Derfor har en absolutt stiv kropp seks grader av frihet. Under translasjonsbevegelse av et legeme endres bare koordinatene til massesenteret, mens vinklene θ, φ og ψ forblir uendret. Derfor kalles de tilsvarende frihetsgradene progressive. (De tre frihetsgradene til et materiell punkt er åpenbart translasjonelle.) Frihetsgradene knyttet til rotasjonen av kroppen kalles roterende. For eksempel endringer i vinklene θ, φ og ψ med et stasjonært massesenter, på grunn av kroppens rotasjon. Av de seks frihetsgradene til et absolutt stivt legeme er således tre translasjons- og tre roterende.
Et system med N materialpunkter, mellom hvilke det ikke er stive forbindelser. har 3N frihetsgrader (posisjonen til hvert punkt bestemmes av tre koordinater). Hver stiv forbindelse, som bestemmer en konstant avstand mellom to punkter, reduserer antallet frihetsgrader med én. For eksempel har et system med to materialpunkter med en elastisk forbindelse tre translasjons-, to rotasjons- og en vibrasjonsfrihetsgrader.
Det er eksperimentelt fastslått at når man skal bestemme antall frihetsgrader for molekyler, må atomer betraktes som materielle punkter. Følgelig bør et monoatomisk molekyl tildeles tre translasjonsgrader av frihet. Et diatomisk molekyl med en stiv binding mellom atomer må tildeles fem frihetsgrader - tre translasjons- og to rotasjonsgrader.
For et hvilket som helst antall frihetsgrader for et molekyl, er tre av dem translasjonelle, og ingen av dem har en fordel fremfor de andre. Derfor har hver av de translasjonelle frihetsgradene i gjennomsnitt den samme energien lik (kT/2), og alle de tre translasjonsfrihetsgradene har en energi lik (3kT/2) i gjennomsnitt.
I henhold til loven om likefordeling på enhver grad av frihet(translasjons-, rotasjons- og oscillerende) i i gjennomsnitt er det samme kinetiske energi, lik kT/2.
Et system som utfører harmoniske svingninger (sinusformet eller cosinus) kalles harmonisk oscillator.
Oscillerende bevegelse (for eksempel svingen av en pendel) er assosiert med tilstedeværelsen av ikke bare kinetisk, men også potensiell energi i det oscillerende systemet. I teorien om oscillasjoner er det bevist at gjennomsnittsverdiene for kinetiske og potensielle energier til en harmonisk oscillator er de samme. Det følger at vibrasjonsfrihetsgraden til et molekyl har, sammenlignet med translasjons- eller rotasjonsgraden, dobbelt så stor kapasitet - for hver vibrasjonsfrihetsgrad er det i gjennomsnitt to halvdeler av kT, en i form av kinetisk energi og en i formen for potensiell energi.
Fra loven om likefordeling av kinetisk energi over frihetsgrader følger det at gjennomsnittsenergien til et molekyl bestemmes av formelen
Loven om ekvideling ble oppnådd på grunnlag av klassiske ideer om naturen til molekylær bevegelse. Derfor er den omtrentlig og brytes i tilfeller der kvanteeffekter blir betydelige.





