Досега, ја користевме идејата за молекули како многу мали еластични топчиња, чија просечна кинетичка енергија се претпоставуваше дека е еднаква на просечната кинетичка енергија на преводното движење (види формула 6.7). Оваа идеја за молекула важи само за монатомски гасови. Во случај на полиатомски гасови, придонесот за кинетичката енергија е исто така направен од ротационото и, при високи температури, вибрационото движење на молекулите.
Со цел да се процени колкав дел од енергијата на молекулата се пресметува со секое од овие движења, го воведуваме концептот степени на слобода. Бројот на степени на слобода на едно тело (во овој случај молекули) се подразбира како број на независни координати, кои целосно ја одредуваат положбата на телото во просторот. Бројот на степени на слобода на молекулата го означуваме со буквата i.
Ако молекулата е монатомска (инертни гасови He, Ne, Ar итн.), тогаш молекулата може да се смета како материјална точка. Бидејќи положбата на материјалот е одредена со три координати x, y, z (сл. 6.2, а), монатомската молекула има три степени на слобода на транслаторно движење (i = 3).

Молекула на диатомски гас (H 2 , N 2 , O 2 ) може да се претстави како збирка од две цврсто поврзани материјални точки - атоми (сл. 6.2, б). За да се одреди позицијата на дијатомската молекула, линеарните координати x, y, z не се доволни, бидејќи молекулата може да ротира околу центарот на координатите. Очигледно е дека таквата молекула има пет степени на слобода (i=5): - три - преводно движење и два - ротација околу координатните оски (од трите агли 1, 2, 3, само два се независни) .
Ако една молекула се состои од три или повеќе атоми кои не лежат на иста права линија (CO 2 , NH 3), тогаш таа (сл. 6.2, в) има шест степени на слобода (i = 6): три - преводно движење и три - ротација околу координатните оски.
Погоре беше прикажано (види формула 6.7) дека просечната кинетичка енергија  преводно движење на идеална молекула на гас, земено како материјалточка, еднакво на 3/2kT. Потоа, на еден степен на слобода на преводно движење има енергија еднаква на 1/2 kT. Овој заклучок во статистичката физика е генерализиран во форма на Болцмановиот закон за рамномерна распределба на молекуларната енергија низ степените на слобода: статистички, во просек, секој степен на слобода на молекулите има иста енергија, ε i, еднаква на:
преводно движење на идеална молекула на гас, земено како материјалточка, еднакво на 3/2kT. Потоа, на еден степен на слобода на преводно движење има енергија еднаква на 1/2 kT. Овој заклучок во статистичката физика е генерализиран во форма на Болцмановиот закон за рамномерна распределба на молекуларната енергија низ степените на слобода: статистички, во просек, секој степен на слобода на молекулите има иста енергија, ε i, еднаква на:
Така, вкупната просечна кинетичка енергија на молекулата
 (6.12)
(6.12)
Во реалноста, молекулите можат да вршат и вибрациони движења, а вибрацискиот степен на слобода отпаѓа, во просек, за двојно повеќе енергија од транслацискиот или ротациониот, т.е. kT. Дополнително, при разгледување на идеалниот модел на гас, по дефиниција не ја земавме предвид потенцијалната енергија на интеракцијата помеѓу молекулите.
Просечен број на судири и просечна слободна патека на молекулите
Удобно е да се карактеризира процесот на судир на молекулите со вредноста на ефективниот дијаметар на молекулите d, што се подразбира како минимално растојание со кое центрите на две молекули можат да се приближат еден кон друг.
Просечното растојание што една молекула минува помеѓу два последователни судири се нарекува значи слободен патмолекули  .
.
Поради случајноста на термичкото движење, траекторијата на молекулата е скршена линија, чии точки на прекин одговараат на точките на нејзиниот судир со други молекули (сл. 6.3). За една секунда, молекулата поминува низ патека еднаква на аритметичката просечна брзина  . Ако
. Ако  - просечниот број на судири во 1 секунда, потоа просечната слободна патека на молекулата помеѓу два последователни судири
- просечниот број на судири во 1 секунда, потоа просечната слободна патека на молекулата помеѓу два последователни судири
 =
= /
/ (6.13)
(6.13)
За одредување  Да ја замислиме молекулата како топка со дијаметар d (другите молекули ќе се сметаат за неподвижни). Должината на патеката што ја минува молекулата за 1 с ќе биде еднаква на
Да ја замислиме молекулата како топка со дијаметар d (другите молекули ќе се сметаат за неподвижни). Должината на патеката што ја минува молекулата за 1 с ќе биде еднаква на  . Молекулата на оваа патека ќе се судри само со оние молекули чии центри се наоѓаат во скршен цилиндар со радиус d (сл. 6.3). Тоа се молекулите А, Б, Ц.
. Молекулата на оваа патека ќе се судри само со оние молекули чии центри се наоѓаат во скршен цилиндар со радиус d (сл. 6.3). Тоа се молекулите А, Б, Ц.

Просечниот број на судири за 1 секунда ќе биде еднаков на бројот на молекули во овој цилиндар:
 = n 0 V,
= n 0 V,
каде n 0 е концентрацијата на молекулите;
V е волуменот на цилиндерот, еднаков на:
V = πd 2 
Така, просечниот број на судири
 = n 0 π
= n 0 π  г 2
г 2
Кога попрецизно се зема предвид движењето на другите молекули
 =
=
 πd 2 n 0
πd 2 n 0  (6.14)
(6.14)
Тогаш просечната слободна патека според (6.13) е еднаква на:
 (6.15)
(6.15)
Така, просечната слободна патека зависи само од ефективниот дијаметар на молекулата d и нивната концентрација n 0 . На пример, да процениме  И
И  . Нека d~10 -10 m,
. Нека d~10 -10 m,  ~500 m/s,n 0 = 3·10 25 m -3, тогаш
~500 m/s,n 0 = 3·10 25 m -3, тогаш  3·10 9 s –1 и
3·10 9 s –1 и  7 ·10 - 8 m при притисок од ~10 5 Pa. Кога притисокот се намалува (види формула 6.8)
7 ·10 - 8 m при притисок од ~10 5 Pa. Кога притисокот се намалува (види формула 6.8)  се зголемува и достигнува големина од неколку десетици метри.
се зголемува и достигнува големина од неколку десетици метри.
1) Степени на слобода- карактеристики на движењето на механичкиот систем. Бројот на степени на слобода го одредува минималниот број на независни променливи (генерализирани координати) неопходни за целосно опишување на движењето на механичкиот систем. Исто така, бројот на степени на слобода е еднаков на вкупниот број на независни равенки кои целосно ја опишуваат динамиката на системот.
Огромното мнозинство на физички системи може да биде не во една, туку во многу состојби, опишани и со континуирани (на пример, координатите на телото) и со дискретни (на пример, квантните броеви на електронот во атомот) променливи. Се нарекуваат независни „насоки“, променливи кои ги карактеризираат состојбите на системот степени на слобода.
2)Број на степени на слобода- најмал број на параметри што треба да се постават за јасно да се одреди положбата на телото во просторот. означено со i.
Минималната вредност што можам да ја земам е 3.
бидејќи три координати x, y, z. Ова значи дека материјалната точка се движи само прогресивно.
Но, ако некое тело или молекула ротира, тогаш на секое ротационо движење му се доделува друг степен на слобода.
Во случај на диатомски гас i=5.
бидејќи неговата молекула може да ротира во две нормални рамнини.
Во случај на триатомски гас i=6.
бидејќи неговата молекула е способна да ротира во три меѓусебно нормални рамнини.
Како што се зголемува температурата, атомите во молекулите почнуваат да вибрираат. На секое осцилаторно движење му се доделуваат два степени на слобода. Едниот одговара на кинетичката енергија, а другиот на енергијата на потенцијалната интеракција. Затоа, со зголемување на температурата, бројот на степени на слобода за 2 или повеќе атомски молекули се зголемува.
М е произволна маса на гас.
N е бројот на честички.
Внатрешна енергија на една молекула
Помножете се со бројот на молекули за да ја добиете енергијата на целиот гас
U - внатрешна енергија ![]()
ако има 1 мол гас ![]()
Ако гасови (nu) молови ![]()
или
Оваа енергија се нарекува внатрешна енергија на идеален гас.
Општо земено, внатрешната енергија на телото е вкупната енергија поврзана со самите молекули, односно нивната „невидлива“ енергија. Ова ја вклучува кинетичката енергија на движењето на самите молекули, кинетичката енергија на движењето на атомите внатре во молекулата (ако молекулата не е монатомска), потенцијалната енергија на интеракција помеѓу атомите внатре во молекулата, па дури и кинетичката енергија на честичките кои ги сочинуваат атомите (јадра и електрони). Меѓутоа, тој не ја вклучува кинетичката енергија што може да ја има гасот ако тој, како целина, се движи, и потенцијалната енергија што може да ја има ако е во полето на некои сили. Внатрешната енергија на дадена маса на идеален гас зависи, како што може да се види од формулите, само од температурата и не зависи ниту од притисокот ниту од волуменот на гасот. (Ова не е точно за неидеалните гасови.)
Од горенаведените формули е јасно дека за да ја промените температурата на гасот, треба да ја промените неговата внатрешна енергија. Промената на енергијата, како што е познато од механиката, е поврзана со работата: енергијата на телото се менува ако телото работи или се работи на телото, и оваа промена е точно еднаква на извршената работа.
Оттука се чини дека произлегува дека промената на температурата на гасот или на кое било тело воопшто може да се постигне само со механичка работа: за да се загрее телото, мора да се работи на него, а за да се излади потребно е да се создадат услови под што самиот би можел да работи. Искуството покажува дека температурата на телото всушност може да се промени со трошење на соодветна механичка работа. На пример, кога телата се тријат едни со други, тие се загреваат (најстариот метод за правење оган се заснова на ова). Како што ќе биде прикажано подолу, гасот може да се загрее и со извршување на работа.
Важна карактеристика на термодинамичкиот систем е неговата внатрешна енергија. Како што е познато, енергијата на телото се состои од кинетичката енергија на движењето на телото со брзина v и потенцијалната енергија на телото во надворешните сили (гравитациони, магнетни, итн.):
Е крзно =(1/2) mv 2 +E пот.
Според МЦТ, сите тела се состојат од молекули кои се во состојба на непрекинато, хаотично движење, односно имаат кинетичка енергија, а поради меѓусебната интеракција имаат потенцијална енергија на интеракција.
Внатрешната енергија е вкупната енергија на хаотичното (термичко) движење на микрочестичките на системот и енергијата на интеракцијата на овие честички.
Внатрешната енергија е недвосмислена функција на термодинамичката состојба на системот (кога системот преминува од една во друга состојба, промената на внатрешната енергија е одредена од разликата во вредностите на внатрешната енергија на овие состојби и не зависи на транзицискиот пат).
Како што е познато од механиката, движењето на телата (или материјалните точки) се случува во просторот и времето. Секое движење на телото може да се претстави како комбинација на транслаторни и ротациони движења. Положбата на телото во секој момент од времето се карактеризира со бројот на степени на слобода.
Бројот на степени на слобода на молекулата е бројот на независни променливи (координати) кои целосно ја одредуваат положбата на системот во просторот.
Како материјална точка може да се смета молекула на монатомски гас (поради малата) на која и се припишуваат три степени на слобода на транслаторно движење: i=i пост (сл. 8).
Ориз. 8. Да се определи бројот на степени на слобода за монатомска молекула
Просечната кинетичка енергија на преводното движење на монатомска молекула на идеален гас е еднаква на:
E 0 = m 0 (v sq ) 2 /2 = 3kT/2.
Ротационите степени на слобода во овој случај не се земени предвид, бидејќи моментот на инерција на дадена молекула во однос на секоја од оските: I x =mr 2, I y =mr 2, I z =mr 2, растојанието до оските на ротација се r→0, затоа I x → 0, I y →0, I z →0, а потоа кинетичката енергија на ротација за секоја од оските:
Е време =Iω 2 →0.
Молекулата на диатомски гас се смета како збир од две материјални точки цврсто поврзани со недеформабилна врска (сл. 9). Покрај трите транслациски степени на слобода, таквата молекула има два ротациони степени на слобода:

Ориз. 9. Да се определи бројот на степени на слобода за диатомска молекула
i=i пост +i ротација =5
Триатомските и полиатомските нелинеарни молекули имаат шест степени на слобода: три транслациски и три ротациони (сл. 10):

Ориз. 10. Да се определи бројот на степени на слобода за триатомска молекула
i=i пост +i ротација =6
Всушност, не постои цврста врска помеѓу атомите. Атомите во молекулата можат да се доближуваат и подалеку, односно да вибрираат околу положбата на рамнотежа. Енергијата на вибрационото движење на молекулата е збир на кинетичка и потенцијална енергија, чии просечни вредности се исти. Така, за вистинските молекули исто така е неопходно да се земат предвид степените на слобода на вибрационото движење.
Во класичната статистичка физика е изведен Болцмановиот закон за рамномерна распределба на енергијата над степените на слобода на молекулите: за статистички систем во состојба на термодинамичка рамнотежа, за секој транслациски и ротациски степени на слобода има просечна кинетичка енергија еднаква на kT/2, а за секој вибрациски степен на слобода – во просек енергијата е еднаква на. Просечната енергија на една молекула е:
(ε)=·kT, (46)
Каде што i=i пост +i ротација +2i осцилација
Утврдено е дека, сепак, енергијата на транслациското и ротационото движење на молекулата е многу помала од енергијата на вибрационото движење на атомите во молекулата, затоа вибрационите степени на слобода се возбудуваат при високи температури.
Внатрешната енергија на идеалниот гас се состои само од кинетичките енергии на сите молекули во даден волумен, бидејќи потенцијалната енергија на интеракција помеѓу молекулите, според претпоставките на моделот на идеален гас (дел 1.3), може да се занемари.
За еден мол идеален гас:
U m =EN A =·kN A T
Внатрешна енергија за произволна маса на идеален гас:
За да ја разбереме врската помеѓу температурата и внатрешната енергија, да го повториме концептот воведен претходно во механиката - број на степени на слобода.
Во § 1.3 се покажа дека притисокгасот е нумерички еднаков импулс, кој се пренесува по единица време на единица површина на ѕидот како резултат на влијанието на молекулите врз него, затоа притисокот се одредува само со просечната енергија прогресивенмолекуларни движења.
Движењето напред на кој било систем „како целина“ е целосно определено со движењето на една единствена точка: нејзиниот центар на маса. Конкретно, вкупниот импулс на кој било нерелативистички систем е еднаков на производот од масата на овој систем и брзината на движење на неговиот центар на маса. Енергијата на преводното движење на системот „како целина“ е еднаква на ![]() . Затоа, за целосен опис на преводното движење на кој било систем во тридимензионалнипростор потребно е и доволно да се наведат вредностите трикоординати на центарот на масата. Така, преведувачкото движење, без разлика како е структуриран системот, секогаш одговара на три транслациски степени на слобода: .
. Затоа, за целосен опис на преводното движење на кој било систем во тридимензионалнипростор потребно е и доволно да се наведат вредностите трикоординати на центарот на масата. Така, преведувачкото движење, без разлика како е структуриран системот, секогаш одговара на три транслациски степени на слобода: .
Можеме да го кажеме ова: „од гледна точка на преводното движење“, секој систем може да се претстави точно, а не приближно, во форма на една единствена материјална точка што се совпаѓа со центарот на масата на системот и има маса еднаква на масата на системот (сл. 1.15).

Ориз. 1.15. Монатомска молекула
Ако зборуваме за вкупната внатрешна енергија на гасот U,тогаш се состои, општо земено, од многу компоненти кои одговараат на сите можни видови на движење во молекулата и енергијата на интеракцијата на молекулите едни со други. Кога се разгледува идеален гас, се занемарува енергијата на интеракцијата на молекулите.
Ајде прво да разгледаме благороден гас, на пример хелиум. Факт е дека сите благородни гасови се монатомски, од кои хелиумот е најлесниот и, соодветно, има наједноставна структура. Атомот на хелиум (што значи главниот изотоп) е позитивно наелектризирано јадро од 2 протони и 2 неутрони и електронска обвивка од 2 негативно наелектризирани електрони. Вкупно 6 честички, ако секоја од нив се смета за материјална точка, тогаш ова е 18 степени на слобода. Но, не е сè толку депресивно мрачно, квантната механика помага. Без да навлегуваме во „квантните“ детали, истакнуваме дека за да се промени состојбата на електронската обвивка на атомот на хелиумот, имено: да се пренесе од основната состојба со минимална можна енергија во возбудена состојба со висока енергија, е неопходно минимуменергија околу 20 eV. Поточно, на пример, кога електронската обвивка на атом на хелиум е возбудена, можна е транзиција која бара 19,8198 eV. Енергетскиот спектар на атомите е дискретен: лесно е да се прифати атом на хелиум со пониска енергија не може, така е дизајниран. Кога атом на хелиум ќе се судри со електрон со пониска енергија, атомот на хелиум ќе остане во почетната - основна состојба со најниска можна внатрешна енергија, чија вредност зависи само од изборот на референтната точка на енергија и, најчесто, едноставно се зема еднакво на нула. Таквиот судир ќе биде апсолутно еластичен. Забележи го тоа
Според тоа, енергија од 20 eV одговара на температура од редот на келвини. Веројатно не е тешко да се разбере дека дури и при температура од К, атомите на хелиум се движат толку брзо што енергијата на нивното релативно движење е 100 пати поголема од нејзината просечна вредност ќе биде занемарлива. Но, тогаш судирите придружени со промена на внатрешната енергија на еден од атомите кои се судираат ќе бидат исклучително ретки, затоа, можното присуство на атоми со возбудена електронска обвивка може да се занемари и приближно може да се претпостави дека сите атоми имаат електронска обвивка. во иста основна состојба со минимална можна енергија . Не е толку важно електронските обвивки на сите атоми да имаат минимална можна енергија, колку што е важно таа истово сите атоми и не се менувадури и кога гасот е многу жежок. Тогаш, вкупната енергија на електронските обвивки на сите атоми е едноставно константа еднаква на , каде Не бројот на атоми во гасот и е енергијата на електронската обвивка на секој атом. За фиксен вкупен број на атоми оваа вредност не зависи од ниту еден параметар на состојбата на гасот. Останува уште еднаш да се запамети дека енергијата секогаш се одредува до адитивна константа и да ја фрлиме оваа константа, менувајќи го потеклото на енергијата.
За да се промени состојбата на атомските јадра, потребна е енергија од стотици илјади eV, која е монструозно висока „на гасните скали“. Соодветните температури се забележани само во внатрешните области на ѕвездите. Затоа, можноста за промена на внатрешната состојба јадрапри судири во гаснема потреба да се каже (ова се однесува на стабилни јадра; можното распаѓање на нестабилните јадра нема никаква врска со параметрите на состојбата на гасот).
Што останува? Она што останува е преводното движење на атомот како целина, односно три транслациски степени на слобода. Ова ја оправдува употребата на овој модел:
За секој случај, да направиме резерва дека во моментов не сме заинтересирани за процесите на воспоставување термодинамичка рамнотежа во гасот. Рамнотежата е воспоставена токму како резултат на интеракцијата на честичките на гасот за време на нивните судири, затоа моделот „атом-материјална точка“ не ги опишува таквите процеси.
Положбата со електронската обвивка не се менува ако атомите се дел од полиатомска молекула. Минималната енергија потребна за промена на состојбата (побудување) на електронската обвивка на молекулите е приближно иста како и за возбудување на електронските обвивки на атомите. Бројката карактеристична за атомско-молекуларниот свет е околу 10 eV, што одговара на температура од околу стотици илјади келвини. На такви температури, гасот повеќе не е гас, туку нискотемпературна плазма. Затоа, додека гасот останува гас, во огромното мнозинство на случаи, можеме со одлична точност да претпоставиме дека електронските обвивки на сите молекули на гас се во иста состојба, нивната вкупна енергија е константа независна од параметрите на состојбата на гасот, што може да се испушти. Се разбира, постојат исклучоци кои бараат одредена претпазливост. На пример, молекулата на кислород има - според атомско-молекуларни стандарди - многу долготрајна возбудена состојба, на која оваа молекула бара само 0,982 eV. Во оваа состојба, молекулата на кислородот е исклучително хемиски активна, ова е многу важен исклучок и интересен по неговите последици, но исклучок што апсолутно мора да се земе предвид при релевантни проблеми, на пример, при пресметување на стапките на хемиски реакции што ја вклучува оваа молекула.
Така, дури и во составот на молекулата, атомот може да се смета како материјална точка.
Дозволете ни да се фокусираме одделно на пресметување на бројот на ротациони и вибрациони степени на слобода на полиатомските молекули. Да почнеме со разгледување на ротационите степени на слобода на диатомска молекула. Сите диатомски молекули се линеарни од едноставна причина што две дивергентни точки дефинираат права линија, со други зборови, две точки секогаш лежат на иста права линија (сл. 1.16). Има и посложени, но линеарни молекули, на пример, молекулата на јаглерод диоксид е линеарна: во основната состојба (со најмала можна енергија) сите три нејзини атоми лежат на иста права линија.

Ориз. 1.16. Диатомска молекула
Обично, при пресметување на внатрешната енергија на гасот, ротацијата на линеарна молекула се зема предвид само околу нејзините две главни оски, минувајќи низ центарот на масата и нормално на оската на молекулата; ротацијата на молекулата околу нејзината оската на симетрија не се разгледува, што е апсолутно точно. Но, на оваа основа се наведува дека линеарна молекула има само 2 ротациони степени на слобода, што е категорично неточно. Сепак, ќе продолжиме да пишуваме вака, што секако бара објаснување. Фактот дека постојат само два ротациони степени на слобода е очигледно неточен поради следната причина. Линеарна молекула е просторна формација која има конечни димензии во сите три димензии. На пример, растојанието помеѓу јадрата во молекулата е метри, а кинетичкиот радиус на гасот (радиусот во моделот: молекула - топка) е еднаков на метри. Радиусите на азотните јадра се од редот на метар. Имајќи го предвид тоа, се поставува легитимно прашање: „Зошто и тој да не ротира околу сопствената оска? Повторно е виновна квантната механика. Квантните механички пресметки покажуваат дека потребната енергија за да се поттикне ротација околу одредена оска е Обратно пропорционално Моментот на инерцијаво однос на оваа оска. Затоа, не зборуваме за возбудлива ротација на јадрата - радиусот на овие „топки“ е премногу мал, и соодветно на тоа, минималната енергија потребна за нивно доведување во ротационо движење е преголема. Ова се повторно стотици килоелектронволти: таканаречените нивоа на ротациона енергија на јадрата. Останува само едно: да се „завитка“ својата електронска обвивка околу оската на молекулата, но секоја промена во состојбата на електронската обвивка бара енергија од редот на 10 eV. Поточно, за да се „изврти“ молекулата околу нејзината оска, односно да се пренесе молекулата во првата ротациона возбудена состојба, потребни се 7,35 eV, што одговара на температура поголема од седумдесет илјади степени. Така, при температури на „гас“, односно на оние температури кога гасот е сè уште гас, а не плазма (помалку од неколку илјади степени), бројот на линеарни молекули што ротираат околу сопствената оска ќе биде занемарлив.

Ориз. 1.17. Линеарна молекула
Општата ситуација е ваква. Очигледно отсуствомолекулата има одредени степени на слобода поради фактот што потребната енергија за возбудување на соодветните видови на движење, поради квантни причини, премногу одлично(не мал!, Сл. 1.17). Молекулите во кои овие типови на движење се возбудени како резултат на судири на молекулите меѓу себе или воопшто не се присутни (во разумни количества гас), или се присутни, но во толку мала релативна количина што придонесот за внатрешната енергија на гасот на овие типови на движење е занемарлива. Ова се однесува на сите оние степени на слобода кои се поврзани со електроните на електронската обвивка на молекулата. Токму поради оваа причина и изолираниот атом и атом во молекулата може да се сметаат како материјална точка (сл. 1.18).

Ориз. 1.18. Триатомска молекула
Со оглед на горенаведеното, одредувањето на бројот на степени на слобода на молекулата во рамките на моделот: „атом - материјална точка“ се сведува на следново.
Ако молекулата се состои од атоми - материјални точки, степени на слобода:
Вкупно- , од нив:
прогресивен- 3 секогаш,
ротационен- 3 (просторна молекула) или 2 (линеарна молекула),
осцилаторни- или за просторни (линеарни) молекули.
Силно препорачуваме да ги броите степените на слобода по овој редослед: сите, преводни, ротациони и она што останува се осцилаторни. Не треба да се потпирате на структурни хемиски формули; тие покажуваат хемиски врски, а не можности за одредени вибрациони движења на групи јадра или поединечни јадра на атомите што ја сочинуваат молекулата. На пример, можноста за торзиони вибрации не се рефлектира на кој било начин. Употребата на овие формули најчесто доведува до грешки при пресметувањето на бројот на вибрациони степени на слобода. Има само едно нешто што треба да знаете за структурата на молекулата: дали е линеарна или не.
Да дадеме три примери за пресметување на бројот на степени на слобода за молекулите ![]() . Ајде прво да воведеме „класичен број“, кој го означуваме како , ќе биде потребен подоцна:
. Ајде прво да воведеме „класичен број“, кој го означуваме како , ќе биде потребен подоцна:
тука е бројот на преведувачки степени на слобода, бројот на ротациони степени на слобода и бројот на вибрациони степени на слобода. Поради двете напред, овој број воопшто не е еднаков на вкупниот број на степени на слобода на молекулата и не треба така да се нарекува.
Табела 1.4.1.
|
молекула / Степени слобода; |
линеарна |
линеарна |
рамен или просторни |
|
|
Прогресивна |
||||
|
Ротациона |
||||
|
Осцилаторни |
||||
Молекулата на етанот има две рамнотежни конфигурации: во еден случај, сите осум атоми лежат во една рамнина; во другата конфигурација на рамнотежа, рамнините во кои лежат четирите и „десните“ четири се меѓусебно нормални. Во двете рамнотежни конфигурации, можни се торзиони вибрации на овие рамнини со атоми во близина на нивните рамнотежни позиции. Вибрациите на атомите, поточно јадрата на атомите кои се дел од полиатомската молекула, се внатрешно движење во молекулата, затоа е најзгодно да се разгледа ова движење во системот на центарот на масата на молекулата.
За да разбереме зошто триатомската молекула на вода има три вибрациски степени на слобода, а триатомската молекула на јаглерод диоксид има четири, да ги разгледаме природните вибрациони начини на јадрата во молекулата .
Четирите начини на вибрации на оваа молекула се како што следува. Симетрична мода: сите три јадра остануваат на иста права линија, јаглеродното јадро е неподвижно, двете јадра на кислород вибрираат во антифаза, односно половина од периодот кога се приближуваат еден кон друг и јадрото на јаглеродот, движејќи се кон него од две спротивни страни; другата половина од периодот тие, сè уште во антифаза, се оддалечуваат едни од други и од јаглеродното јадро. Асиметрична мода: сите три јадра остануваат на иста права линија, две кислородни јадра, како една целина (со постојано растојание меѓу нив) вибрираат во антифаза со јаглеродното јадро. Двојно дегенериран режим на деформација: јадрата не остануваат на иста права линија; во моментот кога ги напуштаат рамнотежните позиции лоцирани на права линија , тие (сите три) се движат во насоки нормални на оваа линија. Ако, релативно кажано, оската на молекулата е хоризонтална и јаглеродното јадро се движи нагоре, тогаш и двете кислородни јадра се движат надолу. Односно, две кислородни јадра вибрираат во фаза едно со друго и надвор од фаза со јаглеродното јадро. Ова е разбирливо: инаку центарот на масата на молекулата нема да остане неподвижен.
Двајца строго еднаквиприродните фреквенции на режимот на двојно дегенерирана деформација одговараат на движењето на јадрата во две меѓусебно нормални рамнини. Ако вибрациите на само еден од двата начини на деформација се возбудени, тогаш сите три јадра остануваат во рамнина фиксирана во вселената. Ако осцилациите се возбудени во двете меѓусебно нормални рамнини (двата режима), тогаш траекториите на сите три јадра, како резултат на додавање на две меѓусебно нормални осцилации со строго еднакви амплитуди, се елипсови, а со еднакви амплитуди и фазни поместувања, тие се кругови. Покрај тоа, ако јаглеродното јадро се движи по својата елипса „во насока на стрелките на часовникот“, тогаш и двете јадра на кислород се движат по нивните идентични елипси „спротивно од стрелките на часовникот“. Зборовите „за“ и „против“ се ставени во наводници од очигледна причина: тие се условни, бидејќи зависат од која страна гледате.
Така, четирите вибрациски степени на слобода на молекулата одговараат на само три различни фреквенции, бидејќи режимот на деформација е двојно дегенериран.
Секоја дијатомска молекула во рамките на моделот „атом - материјална точка“ има еден вибрациски степен на слобода, што одговара на многу едноставно движење: растојанието помеѓу неговите две јадра осцилира. Меѓутоа, честопати макроскопските карактеристики на диатомскиот гас, на пример, неговиот топлински капацитет при константен волумен и притисок, нивниот сооднос - адијабатски експонент и други, имаат (со процентуална точност!) исти вредности како овие молекули да не имаат вибрациски степен на слобода. Нагласуваме дека овој „инцидент“ се случува, прво, не за сите молекули и, второ, само на не премногу високи температури, кои не надминуваат неколку стотици келвини. Оваа ситуација се случува, на пример, за воздух (приближно 80% азот и 20% кислород) на собна температура ![]() . Сосема е очигледно дека бројот на степени на слобода на молекулата не може да зависи од параметрите на состојбата на гасот чиј дел е таа. Овој број се одредува со тродимензионалноста на просторот и моделот: „атом - материјална точка“. Прашањето е: „Што е работата?
. Сосема е очигледно дека бројот на степени на слобода на молекулата не може да зависи од параметрите на состојбата на гасот чиј дел е таа. Овој број се одредува со тродимензионалноста на просторот и моделот: „атом - материјална точка“. Прашањето е: „Што е работата?
За да се возбудат нуклеарните вибрации во молекулата на азот, треба да и се даде енергија не помала од онаа на молекулата на кислород; како што велат во такви случаи, „вибрациониот квант“ е малку помал, имено: . Пред самата квантно-механичка пресметка, ќе ги пријавиме нејзините резултати.
На собна температура ![]() пропорцијата на вибрациски возбудени азотни молекули од нивниот вкупен број ќе биде приближно
пропорцијата на вибрациски возбудени азотни молекули од нивниот вкупен број ќе биде приближно 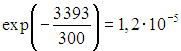 , за кислород оваа фракција е приближно еднаква на
, за кислород оваа фракција е приближно еднаква на  . Така, во секој кубен сантиметар воздух на собна температура ќе има повеќе вибрациски возбудени молекули на азот и по ред на големина повеќе вибрациски возбудени молекули на кислород. Под овие услови, тешко може да се каже дека овие молекули се „цврсти“ и имаат само пет степени на слобода, бидејќи немаат вибрациски степен на слобода. Згора на тоа, веќе на температура од 1000 К процентот на вибрациски возбудени молекули ќе биде околу 3% за азот и околу 10% за кислород. Како друг пример, да разгледаме молекула во која е потребна минимална количина на енергија за да се возбудат вибрациите на нејзините јадра. Веќе на собна температура, процентот на вибрациски возбудени молекули ќе биде приближно 20%. Вибрациите на јадрата во оваа молекула не можат да се занемарат дури и на собна температура.
. Така, во секој кубен сантиметар воздух на собна температура ќе има повеќе вибрациски возбудени молекули на азот и по ред на големина повеќе вибрациски возбудени молекули на кислород. Под овие услови, тешко може да се каже дека овие молекули се „цврсти“ и имаат само пет степени на слобода, бидејќи немаат вибрациски степен на слобода. Згора на тоа, веќе на температура од 1000 К процентот на вибрациски возбудени молекули ќе биде околу 3% за азот и околу 10% за кислород. Како друг пример, да разгледаме молекула во која е потребна минимална количина на енергија за да се возбудат вибрациите на нејзините јадра. Веќе на собна температура, процентот на вибрациски возбудени молекули ќе биде приближно 20%. Вибрациите на јадрата во оваа молекула не можат да се занемарат дури и на собна температура.
Тешко е разумно да се каже дека присуството или отсуството на вибрациски степен на слобода во диатомската молекула зависи од видот на молекулата и температурата на гасот. Ова е обид да се „турне“ вибрационото движење на јадрата, кое е од квантна природа, во рамките на класичниот (неквантен) опис кој во овој случај е несоодветен. Диатомската молекула секогаш има вибрациски степен на слобода, но придонесот на вибрационото движење на јадрата во таквата молекула за внатрешната енергија на гасот, за топлинскиот капацитет и за адијабатичниот индекс и другите карактеристики на гасот може да биде занемарлива ако неравенството е исполнета
![]()
каде е Болцмановата константа воведена погоре. Кога важи спротивната нееднаквост
Вибрационото движење на јадрата не може да се занемари. Класичен (не-квантен) опис на вибрационото движење на јадрата во молекулите е возможен само во случај на мала енергија на возбудување на вибрационото движење и доволно висока температура, имено: кога нееднаквоста
![]() ,
,
што во пракса се спроведува само во ретки исклучителни случаи како молекула. Во воздухот што можеме релативно удобно да го дишеме, вибрациите на јадрата во молекулите не се опишани со класичната механика.
Сега да се вратиме на идеалниот гас. Видовме дека просечната кинетичка енергија на преводното движење на молекулите е еднаква на
![]()
а тоа преводно движење одговара на три степени на слобода. Тоа значи дека по степен на слобода, во состојба на термодинамичка рамнотежа, постои просечна енергија
Со класичен (не квантен) опис, сите видови на движење се еднакви. Молекулите се судираат и во овој случај лесно може да се случи енергијата на транслациското движење да се претвори во енергија на ротационото движење. Затоа, секој од ротационите степени на слобода треба да има во просек иста количина на енергија -
Оваа изјава е позната како Болцмановиот закон за рамномерна распределба на енергијата над степените на слобода.На сличен начин, судирите на молекулите можат да доведат до вибрациони движења на јадрата во нив, така што класичниот закон за еднаквост се применува и на вибрационите степени на слобода на молекулите. Но, тука има една суптилност. Ако само кинетичката енергија одговара на преводните и ротационите движења, тогаш хармоничниот осцилатор (еден вибрациски степен на слобода) има во просек строго еднакви кинетичка и потенцијална енергија. Затоа, во просек, во состојба на термодинамичка рамнотежа, под услови на применливост на класичниот опис на осцилаторното движење, за еден вибрациски степен на слобода има енергија двојно поголема; ова воопшто не е номиналниот број на вибрациони степени на полиатомска молекула, тогаш просечната енергија на една молекула ќе биде еднаква на
ќе се сретнеме во следното поглавје, каде што значењето на овој поим ќе стане појасно. Како што беше прикажано погоре, вибрационото движење на јадрата во молекулите се возбудува само кога ќе се достигнат доволно високи температури ( Т > 1000 К), затоа нивниот придонес во внатрешната енергија на гасот за повеќето молекули на обични (блиску до собни) температури е занемарлив, нема да го земеме предвид, т.е. доколку не е поинаку наведеноќе претпоставиме дека
![]() ,
,
каде и се еднакви на номиналниот број на транслациони (секогаш 3) и ротациони (3 или 2) степени на слобода, според структурата на молекулата.
Пример.Во просторија со волумен 75 m 3Постои диатомски гас (воздух) на температура t = 12 °C (Т = 285 К). Вклучете го грејачот и подигнете ја температурата на воздухот до t 2 = 22 °C (Т 2 = 295 К). Бидејќи просторијата не е запечатена, притисокот на гасот останува постојан и еднаков цело време 100 kPa. Ајде да ја пронајдеме промената на внатрешната енергија на гасот во просторијата и да утврдиме колку енергија е потрошена за загревање на околината.
Одговорот е малку неочекуван: според (1.19), внатрешната енергија на гасот во просторијата не е променета, бидејќи и неговиот притисок и волуменот останаа исти. Од друга страна, дел од гасот ја напуштил просторијата: ако на почетокот содржел
Бидејќи внатрешната енергија е пропорционална на апсолутната температура, по загревањето на затворената просторија излегува дека

односно од шпоретот се добива енергија
Во втората фаза се отстрануваме од собата 3,39 % загреан воздух, а со тоа и ист удел на енергија. Отстранета енергија
точно еднаква на енергијата добиена од шпоретот. На поинаков начин повторно дојдовме до истиот заклучок.
Така, сега конечно е јасно дека воздухот што излета на улица ја понесе со себе сета енергија добиена од шпоретот. Која е тогаш улогата на шпоретот? Вредеше ли воопшто да го вклучите ако само ја загрева улицата? Корисното дејство на шпоретот е што на температура од 12 степени загубата на топлина на човекот во околниот воздух е толку голема (и покрај фактот дека е облечен, мора да се претпостави) дека системот за терморегулација на телото има потешкотии да одржува нормална температура. и го сигнализира ова: ладно е личност, непријатно! И на температура од 22 степени, загубата на топлина е значително помала, оптоварувањето на системот за терморегулација е помало - едно лице се чувствува прилично удобно и нема желба да го вклучи грејачот.
дополнителни информации
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - J. de Boer Вовед во молекуларна физика и термодинамика, Ед. IL, 1962 - стр. 50–61, дел I, § 6, - дадени се теоретско пресметување на топлинските капацитети, експериментални зависности на топлинскиот капацитет при константен волумен во широк температурен опсег за десет специфични гасови.
Ајде да ги споредиме изразите
Термодинамичката температура е вредност пропорционална на просечната енергија на преводното движење на молекулите.
Само молекулите на гас се движат прогресивно; движењето на молекулите во течни и цврсти тела е од различна природа.
Важно е просечната енергија на молекулите да зависи само од температурата и да не зависи од масата на молекулата.
Воведување ![]() , и споредувајќи со
, и споредувајќи со ![]() , добиваме:
, добиваме:
|
|
(43 .3 ) |
Квадратниот корен на количината се нарекува корен средна квадратна брзина на молекулите. Само монатомските молекули се движат напред. Ди- и полиатомските молекули, покрај преводното движење, можат да вршат и ротационо и вибрационо движење. Овие типови на движење се поврзани со одредена количина на енергија, која може да се пресмета со законот за рамномерна распределба на енергијата над степените на слобода на молекулата утврдени со класичната физика (т.е. врз основа на Њутновите закони) и статистичката физика.
Да го воведеме концептот на бројот на степени на слобода на механички систем.
Бројот на степени на слобода на механички систем е бројот на независни величини со чија помош може да се определи положбата на системот во просторот.
Позицијата на материјалната точка во просторот се определува со вредностите на нејзините три координати, на пример, Декартови координати x, y, z или сферични координати r, θ, φ, итн. Во согласност со ова, материјална точка има тристепени на слобода.
Положбата на апсолутно круто тело (ARB) може да се одреди со помош на координатите x, y, z на неговиот центар на маса и аглите θ, φ и ψ, што ја покажува ориентацијата на телото во просторот.

Координатите на центарот на маса C се одредуваат во фиксен референтен систем x, y, z. Помошните координатни оски x´, y´, z´ се движат транслаторно заедно со телото. Меѓусебните нормални оски AA и BB се цврсто поврзани со телото. Правата линија A´A´ е проекција на оската AA на x´ z´ рамнината. Аглите φ и υ ја одредуваат ориентацијата во просторот на оската AA и A`A`. Аголот θ ја одредува ориентацијата на експлозивната оска.
Затоа, апсолутно круто тело има шестстепени на слобода. За време на транслациското движење на телото се менуваат само координатите на центарот на масата, додека аглите θ, φ и ψ остануваат непроменети. Затоа се нарекуваат соодветните степени на слобода прогресивен. (Трите степени на слобода на материјална точка очигледно се преведувачки.) Степените на слобода поврзани со ротацијата на телото се нарекуваат ротационен. На пример, промени во аглите θ, φ и ψ со неподвижен центар на маса, поради ротацијата на телото. Така, од шесте степени на слобода на апсолутно круто тело, три се преводни и три се ротациони.
Систем од N материјални точки, меѓу кои нема цврсти врски. има 3N степени на слобода (позицијата на секоја точка се одредува со три координати). Секоја цврста врска, која одредува константно растојание помеѓу две точки, го намалува бројот на степени на слобода за еден. На пример, систем од две материјални точки со еластична врска има три транслациски, два ротациони и еден вибрациски степени на слобода.
Експериментално е утврдено дека при определување на бројот на степени на слобода на молекулите, атомите мора да се земат предвид како материјални точки. Според тоа, на монатомската молекула треба да и се доделат три транслациски степени на слобода. На дијатомската молекула со цврста врска меѓу атомите мора да и се доделат пет степени на слобода - три транслациски и два ротациони.
За кој било број на степени на слобода на молекулата, три од нив се преведувачки и ниту еден нема предност во однос на другите. Според тоа, секој од преводните степени на слобода има во просек иста енергија еднаква на (kT/2), а сите три транслациски степени на слобода имаат енергија еднаква на (3kT/2) во просек.
Според законот за еквидистрибуција на секој степен на слобода(преводна, ротациона и осцилаторна) во во просек има иста кинетичка енергија, еднаква на kT/2.
Систем кој врши хармонски осцилации (синусоидални или косинус) се нарекува хармоничен осцилатор.
Осцилаторното движење (на пример, замавнувањето на нишалото) е поврзано со присуството на не само кинетичка, туку и потенцијална енергија во осцилирачкиот систем. Во теоријата на осцилациите е докажано дека просечните вредности на кинетичката и потенцијалната енергија на хармоничниот осцилатор се исти. Следи дека вибрациониот степен на слобода на молекулата има, во споредба со транслацискиот или ротациониот, двојно поголем капацитет - за секој вибрациски степен на слобода има во просек две половини од kT, една во форма на кинетичка енергија и една во форма на потенцијална енергија.
Од законот за рамномерна распределба на кинетичката енергија над степените на слобода произлегува дека просечната енергија на молекулата се определува со формулата
Законот за еднаквост е добиен врз основа на класичните идеи за природата на молекуларното движење. Затоа, тој е приближен и е повреден во случаи кога квантните ефекти стануваат значајни.





