Осы уақытқа дейін біз молекулалар идеясын өте кішкентай серпімді шарлар ретінде қолдандық, олардың орташа кинетикалық энергиясы трансляциялық қозғалыстың орташа кинетикалық энергиясына тең деп есептелді (6.7 формуласын қараңыз). Молекула туралы бұл идея тек бір атомды газдар үшін жарамды. Көп атомды газдар жағдайында кинетикалық энергияға молекулалардың айналмалы және жоғары температурада тербеліс қозғалысы да үлес қосады.
Осы қозғалыстардың әрқайсысы молекула энергиясының қандай бөлігін құрайтынын бағалау үшін біз тұжырымдаманы енгіземіз. еркіндік дәрежелері. Дененің еркіндік дәрежелерінің саны (бұл жағдайда молекулалар) деп түсініледі тәуелсіз координаталар саны, ол дененің кеңістіктегі орнын толығымен анықтайды. Молекуланың еркіндік дәрежелерінің санын i әрпімен белгілейміз.
Егер молекула бір атомды болса (инерттік газдар He, Ne, Ar және т.б.), онда молекуланы материалдық нүкте ретінде қарастыруға болады. Материалдың орны x, y, z үш координаталарымен анықталатындықтан (6.2, а-сурет), бір атомды молекуланың ілгерілемелі қозғалыс еркіндігінің үш дәрежесі бар (i = 3).

Екі атомды газ молекуласын (H 2 , N 2 , O 2 ) екі қатты байланысқан материалдық нүктелердің – атомдардың жиынтығы ретінде көрсетуге болады (6.2, б-сурет). Екі атомды молекуланың орнын анықтау үшін x, y, z сызықтық координаталары жеткіліксіз, өйткені молекула координаталар центрінің айналасында айнала алады. Мұндай молекуланың бес еркіндік дәрежесі (i=5) болатыны анық: - үш - ілгерілемелі қозғалыс және екеуі - координаталық осьтер айналасында айналу (үш бұрыштың 1, 2, 3, тек екеуі ғана тәуелсіз) .
Егер молекула бір түзу бойында жатпайтын үш немесе одан да көп атомдардан тұрса (CO 2 , NH 3), онда оның (6.2-сурет, в) алты еркіндік дәрежесі (i = 6): үш – ілгерілемелі қозғалыс. және үш - координат осьтерінің айналасында айналу.
Жоғарыда көрсетілген (6.7 формуланы қараңыз) орташа кинетикалық энергия  ретінде қабылданған идеал газ молекуласының трансляциялық қозғалысы материалнүкте, 3/2кТ тең. Сонда трансляциялық қозғалыс еркіндігінің бір дәрежесі үшін 1/2кТ энергия болады. Статистикалық физикадағы бұл тұжырым молекулалық энергияның еркіндік дәрежелері бойынша біркелкі таралуы туралы Больцман заңы түрінде қорытылады: статистикалық тұрғыдан алғанда, молекулалардың кез келген еркіндік дәрежесі бірдей энергияға ие, ε i, мынаған тең:
ретінде қабылданған идеал газ молекуласының трансляциялық қозғалысы материалнүкте, 3/2кТ тең. Сонда трансляциялық қозғалыс еркіндігінің бір дәрежесі үшін 1/2кТ энергия болады. Статистикалық физикадағы бұл тұжырым молекулалық энергияның еркіндік дәрежелері бойынша біркелкі таралуы туралы Больцман заңы түрінде қорытылады: статистикалық тұрғыдан алғанда, молекулалардың кез келген еркіндік дәрежесі бірдей энергияға ие, ε i, мынаған тең:
Сонымен, молекуланың жалпы орташа кинетикалық энергиясы
 (6.12)
(6.12)
Шындығында, молекулалар діріл қозғалыстарын да орындай алады және еркіндіктің діріл дәрежесі трансляциялық немесе айналмалы энергияға қарағанда орта есеппен екі есе көп энергияны құрайды, яғни. кТ. Сонымен қатар, идеалды газ моделін қарастырған кезде, анықтама бойынша молекулалар арасындағы әрекеттесудің потенциалдық энергиясын есепке алмадық.
Соқтығыстардың орташа саны және молекулалардың орташа еркін жүру жолы
Молекулалардың соқтығысу процесін екі молекуланың орталықтары бір-біріне жақындай алатын ең аз қашықтық деп түсінілетін d молекулаларының тиімді диаметрінің мәнімен сипаттау ыңғайлы.
Молекуланың екі рет соқтығысуы арасындағы орташа қашықтық деп аталады еркін жолды білдіредімолекулалар  .
.
Жылу қозғалысының кездейсоқтығына байланысты молекуланың траекториясы сынық сызық болып табылады, оның үзілу нүктелері оның басқа молекулалармен соқтығысу нүктелеріне сәйкес келеді (6.3-сурет). Бір секундта молекула орташа арифметикалық жылдамдыққа тең жолды жүреді  . Егер
. Егер  - 1 секундтағы соқтығыстардың орташа саны, содан кейін екі рет соқтығысқан молекуланың орташа еркін жолы
- 1 секундтағы соқтығыстардың орташа саны, содан кейін екі рет соқтығысқан молекуланың орташа еркін жолы
 =
= /
/ (6.13)
(6.13)
Анықтау үшін  Молекуланы диаметрі d шар түрінде елестетейік (басқа молекулалар қозғалыссыз болып саналады). Молекуланың 1 с ішінде жүріп өткен жолының ұзындығы тең болады
Молекуланы диаметрі d шар түрінде елестетейік (басқа молекулалар қозғалыссыз болып саналады). Молекуланың 1 с ішінде жүріп өткен жолының ұзындығы тең болады  . Бұл жолдағы молекула центрі радиусы d сынық цилиндрдің ішінде жатқан молекулалармен ғана соқтығысады (6.3-сурет). Бұл A, B, C молекулалары.
. Бұл жолдағы молекула центрі радиусы d сынық цилиндрдің ішінде жатқан молекулалармен ғана соқтығысады (6.3-сурет). Бұл A, B, C молекулалары.

1 секундтағы соқтығыстардың орташа саны осы цилиндрдегі молекулалар санына тең болады:
 =n 0 В,
=n 0 В,
мұндағы n 0 – молекулалардың концентрациясы;
V – цилиндрдің көлемі, мынаған тең:
V = πd 2 
Осылайша, соқтығыстардың орташа саны
 = n 0 π
= n 0 π  d 2
d 2
Басқа молекулалардың қозғалысын дәлірек есепке алғанда
 =
=
 πd 2 n 0
πd 2 n 0  (6.14)
(6.14)
Сонда (6.13) бойынша орташа еркін жол мынаған тең:
 (6.15)
(6.15)
Осылайша, орташа еркін жол тек молекуланың тиімді диаметріне d және олардың концентрациясына n 0 байланысты. Мысалы, есептеп көрейік  Және
Және  . d~10 -10 м болсын,
. d~10 -10 м болсын,  ~500 м/с,n 0 = 3·10 25 м -3 , сонда
~500 м/с,n 0 = 3·10 25 м -3 , сонда  3·10 9 с –1 және
3·10 9 с –1 және  7 ·10 - 8 м ~10 5 Па қысымда. Қысым төмендегенде (6.8 формуланы қараңыз)
7 ·10 - 8 м ~10 5 Па қысымда. Қысым төмендегенде (6.8 формуланы қараңыз)  артып, бірнеше ондаған метрге жетеді.
артып, бірнеше ондаған метрге жетеді.
1) Еркіндік дәрежелері- механикалық жүйенің қозғалыс сипаттамасы. Еркіндік дәрежелерінің саны механикалық жүйенің қозғалысын толық сипаттау үшін қажетті тәуелсіз айнымалылардың (жалпыланған координаттардың) ең аз санын анықтайды. Сондай-ақ еркіндік дәрежелерінің саны жүйенің динамикасын толық сипаттайтын тәуелсіз теңдеулердің жалпы санына тең.
Физикалық жүйелердің басым көпшілігі үздіксіз (мысалы, дененің координаталары) және дискретті (мысалы, атомдағы электронның кванттық сандары) айнымалыларымен сипатталатын бір емес, көп күйде болуы мүмкін. Жүйенің күйлерін сипаттайтын тәуелсіз «бағыттар», айнымалылар деп аталады еркіндік дәрежелері.
2)Еркіндік дәрежелерінің саны- дененің кеңістіктегі орнын нақты анықтау үшін орнату қажет параметрлердің ең аз саны. i арқылы белгіленеді.
Мен қабылдай алатын ең аз мән - 3.
өйткені үш координат x, y, z. Бұл материалдық нүктенің тек прогрессивті түрде қозғалатынын білдіреді.
Бірақ егер дене немесе молекула айналса, онда әрбір айналу қозғалысына басқа еркіндік дәрежесі тағайындалады.
Екі атомды газ жағдайында i=5.
өйткені оның молекуласы екі перпендикуляр жазықтықта айнала алады.
Үш атомды газ жағдайында i=6.
өйткені оның молекуласы үш өзара перпендикуляр жазықтықта айналуға қабілетті.
Температура жоғарылаған сайын молекулалардағы атомдар тербеле бастайды. Әрбір тербелмелі қозғалысқа екі еркіндік дәрежесі беріледі. Біреуі кинетикалық энергияға, екіншісі потенциалдық әрекеттесу энергиясына сәйкес келеді. Демек, температураның жоғарылауымен 2 немесе одан да көп атомдық молекулалар үшін еркіндік дәрежелерінің саны артады.
M – газдың ерікті массасы.
N - бөлшектердің саны.
Бір молекуланың ішкі энергиясы
Бүкіл газдың энергиясын алу үшін молекулалар санына көбейтіңіз
U – ішкі энергия ![]()
1 моль газ болса ![]()
Егер газ (nu) моль ![]()
немесе
Бұл энергия идеал газдың ішкі энергиясы деп аталады.
Жалпы алғанда, дененің ішкі энергиясы дегеніміз молекулалардың өздеріне байланысты жалпы энергия, яғни олардың «көрінбейтін» энергиясы. Бұған молекулалардың өздерінің қозғалысының кинетикалық энергиясы, молекула ішіндегі атомдар қозғалысының кинетикалық энергиясы (егер молекула бір атомды болмаса), молекула ішіндегі атомдар арасындағы әрекеттесудің потенциалдық энергиясы, тіпті молекуланың кинетикалық энергиясы жатады. атомдарды құрайтын бөлшектер (ядролар мен электрондар). Бірақ оған газ тұтастай қозғалған кезде ие болатын кинетикалық энергия және кейбір күштер өрісінде болған жағдайда оның потенциалдық энергиясы кірмейді. Идеал газдың берілген массасының ішкі энергиясы, формулалардан көрініп тұрғандай, тек температураға тәуелді және газдың қысымына да, көлеміне де тәуелді емес. (Бұл идеалды емес газдар үшін дұрыс емес.)
Жоғарыда келтірілген формулалардан газдың температурасын өзгерту үшін оның ішкі энергиясын өзгерту керек екені түсінікті. Энергияның өзгеруі, механикадан белгілі, жұмыспен байланысты: дененің энергиясы, егер дене жұмыс істесе немесе денеде жұмыс істесе өзгереді және бұл өзгеріс орындалған жұмысқа тура тең.
Осы жерден газдың немесе жалпы кез келген дененің температурасының өзгеруіне механикалық жұмыс арқылы ғана қол жеткізуге болатыны шығады: денені қыздыру үшін оған жұмыс істеу керек, ал салқындату үшін жағдай жасау керек. оның өзі жұмыс істей алатын. Тәжірибе көрсеткендей, дене температурасын шын мәнінде тиісті механикалық жұмыстарды жұмсау арқылы өзгертуге болады. Мысалы, денелер бір-біріне үйкелу кезінде олар қызады (от жағудың ең көне әдісі осыған негізделген). Төменде көрсетілгендей, газды жұмысты орындау арқылы да жылытуға болады.
Термодинамикалық жүйенің маңызды сипаттамасы оның ішкі энергиясы болып табылады. Белгілі болғандай, дененің энергиясы дененің v жылдамдығымен қозғалысының кинетикалық энергиясынан және дененің сыртқы күш өрістеріндегі (гравитациялық, магниттік және т.б.) потенциалдық энергиясынан тұрады:
E жүн =(1/2) mv 2 +E тер.
МКТ бойынша барлық денелер үздіксіз, ретсіз қозғалыс күйінде болатын молекулалардан тұрады, яғни олардың кинетикалық энергиясы бар және бір-бірімен әрекеттесуіне байланысты потенциалдық әрекеттесу энергиясы болады.
Ішкі энергия – жүйенің микробөлшектерінің хаотикалық (жылу) қозғалысының толық энергиясы және осы бөлшектердің өзара әрекеттесу энергиясы.
Ішкі энергия - жүйенің термодинамикалық күйінің бір мәнді функциясы (жүйе бір күйден екінші күйге өткенде ішкі энергияның өзгеруі осы күйлердің ішкі энергиясының мәндерінің айырмашылығымен анықталады және тәуелді емес өту жолында).
Механикадан белгілі болғандай, денелердің (немесе материалдық нүктелердің) қозғалысы кеңістікте және уақытта жүреді. Дененің кез келген қозғалысы трансляциялық және айналмалы қозғалыстардың қосындысы ретінде ұсынылуы мүмкін. Уақыттың әр сәтіндегі дененің жағдайы еркіндік дәрежелерінің санымен сипатталады.
Молекуланың еркіндік дәрежелерінің саны жүйенің кеңістіктегі орнын толығымен анықтайтын тәуелсіз айнымалылар (координаталар) саны.
Бір атомды газдың молекуласын (ұсақтығына байланысты) материалдық нүкте ретінде қарастыруға болады, оған ілгерілемелі қозғалыс еркіндігінің үш дәрежесі жатқызылады: i=i пост (8-сурет).
Күріш. 8. Бір атомды молекуланың еркіндік дәрежесінің санын анықтау
Идеал газдың бір атомды молекуласының ілгерілемелі қозғалысының орташа кинетикалық энергиясы мынаған тең:
E 0 = m 0 (v sq ) 2 /2 = 3кТ/2.
Бұл жағдайда айналу еркіндік дәрежелері есепке алынбайды, өйткені берілген молекуланың осьтердің әрқайсысына қатысты инерция моменті: I x =mr 2, I y =mr 2, I z =mr 2, дейінгі қашықтық айналу осьтері r→0, сондықтан I x → 0, I y →0, I z →0, онда әрбір ось үшін айналудың кинетикалық энергиясы:
Е уақыты =Iω 2 →0.
Екі атомды газ молекуласы деформацияланбайтын байланыс арқылы қатты байланысқан екі материалдық нүктелердің жиынтығы ретінде қарастырылады (9-сурет). Үш трансляциялық еркіндік дәрежесінен басқа, мұндай молекуланың екі айналу еркіндік дәрежесі бар:

Күріш. 9. Екі атомды молекуланың еркіндік дәрежесінің санын анықтау
i=i пост +i айналымы =5
Үш атомды және көп атомды сызықты емес молекулалардың алты еркіндік дәрежесі бар: үш ілгерілемелі және үш айналмалы (10-сурет):

Күріш. 10. Үш атомды молекуланың еркіндік дәрежесінің санын анықтау
i=i пост +i айналымы =6
Шындығында атомдар арасында қатаң байланыс жоқ. Молекуладағы атомдар бір-бірінен жақындап, алшақтай алады, яғни тепе-теңдік орнында тербеле алады. Молекуланың тербеліс қозғалысының энергиясы - бұл кинетикалық және потенциалдық энергиялардың қосындысы, олардың орташа мәндері бірдей. Сонымен, нақты молекулалар үшін тербеліс қозғалысының еркіндік дәрежелерін де ескеру қажет.
Классикалық статистикалық физикада молекулалардың еркіндік дәрежелері бойынша энергияның біркелкі таралуы туралы Больцман заңы шығарылады: термодинамикалық тепе-теңдік күйіндегі статистикалық жүйе үшін әрбір ілгерілемелі және айналмалы еркіндік дәрежесі үшін мынаған тең орташа кинетикалық энергия болады. кТ/2, ал еркіндіктің әрбір діріл дәрежесі үшін – орташа энергия тең. Молекуланың орташа энергиясы:
(ε)=·kT, (46)
Мұндағы i=i пост +i айналу +2i тербеліс
Алайда, молекуланың ілгерілемелі және айналмалы қозғалысының энергиясы молекуладағы атомдардың тербеліс қозғалысының энергиясынан әлдеқайда аз болатыны анықталды, сондықтан тербеліс еркіндік дәрежелері жоғары температурада қозғалады.
Идеал газдың ішкі энергиясы тек берілген көлемдегі барлық молекулалардың кинетикалық энергияларынан тұрады, өйткені идеал газ үлгісінің (1.3-бөлім) болжамдары бойынша молекулалардың өзара әрекеттесуінің потенциалдық энергиясын елемеуге болады.
Бір моль идеал газ үшін:
U m =EN A =·kN A T
Идеал газдың ерікті массасының ішкі энергиясы:
Температура мен ішкі энергия арасындағы байланысты түсіну үшін механикада бұрын енгізілген тұжырымдаманы қайталайық - еркіндік дәрежелерінің саны.
§ 1.3-те бұл көрсетілген қысымгаз сан жағынан тең импульс, ол молекулалардың оған әсер етуі нәтижесінде қабырғаның бірлік ауданына уақыт бірлігінде тасымалданады, сондықтан қысым тек орташа энергиямен анықталады прогрессивтімолекулалық қозғалыстар.
Кез келген жүйенің «жалпы» алға қозғалысы бір нүктенің қозғалысымен толығымен анықталады: оның массалар центрі. Атап айтқанда, кез келген релятивистік емес жүйенің толық импульсі осы жүйенің массасы мен оның массалар центрінің қозғалыс жылдамдығының көбейтіндісіне тең. Жүйенің трансляциялық қозғалысының энергиясы «тұтастай» тең ![]() . Сондықтан кез келген жүйенің трансляциялық қозғалысын толық сипаттау үшін үш өлшемдібос орын мәндерді көрсету үшін қажет және жеткілікті үшмассалар центрінің координаталары. Осылайша, ілгерілемелі қозғалыс, жүйенің құрылымына қарамастан, әрқашан үш трансляциялық еркіндік дәрежесіне сәйкес келеді: .
. Сондықтан кез келген жүйенің трансляциялық қозғалысын толық сипаттау үшін үш өлшемдібос орын мәндерді көрсету үшін қажет және жеткілікті үшмассалар центрінің координаталары. Осылайша, ілгерілемелі қозғалыс, жүйенің құрылымына қарамастан, әрқашан үш трансляциялық еркіндік дәрежесіне сәйкес келеді: .
Біз былай деп айта аламыз: «аудармалы қозғалыс тұрғысынан» кез келген жүйені жүйенің массалар центрімен сәйкес келетін және массасы тең болатын бір материалдық нүкте түрінде шамамен емес, дәл көрсетуге болады. жүйенің массасы (1.15-сурет).

Күріш. 1.15. Монатомды молекула
Егер газдың толық ішкі энергиясы туралы айтатын болсақ U,онда ол, жалпы айтқанда, молекуладағы қозғалыстың барлық мүмкін түрлеріне және молекулалардың бір-бірімен әрекеттесу энергиясына сәйкес келетін көптеген компоненттерден тұрады. Идеал газды қарастырғанда молекулалардың әрекеттесу энергиясы ескерілмейді.
Алдымен асыл газды қарастырайық, мысалы, гелий. Өйткені, барлық асыл газдар бір атомды, оның ішінде гелий ең жеңіл және, тиісінше, ең қарапайым құрылымға ие. Гелий атомы (негізгі изотопты білдіреді) 2 протон мен 2 нейтроннан тұратын оң зарядталған ядро және теріс зарядталған 2 электроннан тұратын электронды қабат. Барлығы 6 бөлшек, егер олардың әрқайсысы материалдық нүкте деп есептелсе, онда бұл 18 еркіндік дәрежесі. Бірақ бәрі соншалықты көңілсіз емес, кванттық механика көмектеседі. «Кванттық» бөлшектерге бармай-ақ, біз гелий атомының электрондық қабықшасының күйін өзгерту үшін, атап айтқанда: оны ең аз ықтимал энергиямен негізгі күйден жоғары энергиясы бар қозған күйге ауыстыру үшін, ол қажет минимумэнергиясы шамамен 20 эВ. Дәлірек айтқанда, мысалы, гелий атомының электронды қабаты қоздырылған кезде 19,8198 эВ қажет болатын ауысу мүмкін. Атомдардың энергетикалық спектрі дискретті: энергиясы төмен гелий атомын қабылдау оңай мүмкін емес, ол осылай жобаланған. Гелий атомы энергиясы төмен электронмен соқтығысқан кезде гелий атомы бастапқы күйінде қалады - ішкі энергиясы ең төмен, оның мәні тек энергияның эталондық нүктесін таңдауға байланысты және көбінесе, жай ғана нөлге тең қабылданады. Мұндай соқтығыс абсолютті серпімді болады. Ескертіп қой
Демек, 20 эВ энергиясы кельвин ретіндегі температураға сәйкес келеді. Тіпті К температурада гелий атомдарының салыстырмалы қозғалысының энергиясы оның орташа мәнінен 100 есе көп болатыны соншалықты жылдам қозғалатынын түсіну қиын емес. Бірақ содан кейін соқтығысатын атомдардың біреуінің ішкі энергиясының өзгеруімен жүретін соқтығыстар өте сирек болады, сондықтан қозған электрон қабаты бар атомдардың болуы мүмкін екенін елемеуге болады және шамамен барлық атомдарда электронды қабық бар деп болжауға болады. ең аз ықтимал энергиямен бірдей негізгі күйде. Барлық атомдардың электронды қабықшаларының ең аз ықтимал энергияға ие болуы соншалықты маңызды емес, өйткені бұл маңызды бірдейбарлық атомдарда және өзгерген емесгаз өте ыстық болса да. Сонда барлық атомдардың электронды қабаттарының жалпы энергиясы жай ғана тең тұрақты болады, мұндағы Нгаздағы атомдар саны және әрбір атомның электрондық қабатының энергиясы. Атомдардың белгіленген жалпы саны үшін бұл мән газ күйінің ешқандай параметрлеріне тәуелді емес. Энергия әрқашан аддитивті тұрақтыға дейін анықталатынын тағы бір рет еске түсіру керек және бұл тұрақтыны тастап, энергияның шығу тегін өзгертіңіз.
Атом ядроларының күйін өзгерту үшін жүздеген мың эВ энергия қажет, бұл «газ таразысында» өте жоғары. Сәйкес температура жұлдыздардың ішкі аймақтарында ғана байқалады. Сондықтан ішкі күйді өзгерту мүмкіндігі өзектерсоқтығыстар кезінде газдаайтудың қажеті жоқ (бұл тұрақты ядроларға қатысты; тұрақсыз ядролардың ықтимал ыдырауының газ күйінің параметрлеріне еш қатысы жоқ).
Не қалды? Жалпы атомның трансляциялық қозғалысы, яғни үш еркіндік дәрежесі қалады. Бұл осы модельді пайдалануды негіздейді:
Тек жағдайда, біз қазір газда термодинамикалық тепе-теңдікті орнату процестеріне қызығушылық танытпайтынымызды ескертейік. Тепе-теңдік дәл олардың соқтығысуы кезінде газ бөлшектерінің өзара әрекеттесуінің нәтижесінде орнатылады, сондықтан «атом-материалдық нүкте» моделі мұндай процестерді сипаттамайды.
Егер атомдар полиатомды молекуланың бөлігі болса, электронды қабықшасының орны өзгермейді. Молекулалардың электронды қабықшасының күйін (қозуын) өзгерту үшін қажетті минималды энергия атомдардың электронды қабаттарының қозуымен бірдей. Атомдық-молекулалық әлемге тән фигура шамамен 10 эВ, ол шамамен жүздеген мың кельвиндік температураға сәйкес келеді. Мұндай температурада газ енді газ емес, төмен температуралы плазма болады. Демек, газ газ күйінде қалғанымен, көп жағдайда барлық газ молекулаларының электронды қабаттары бірдей күйде, олардың толық энергиясы газ күйінің параметрлеріне тәуелсіз тұрақты, оны өткізіп жіберуге болады. Әрине, сақтықты қажет ететін ерекше жағдайлар бар. Мысалы, оттегі молекуласы - атомдық-молекулалық стандарттар бойынша - бұл молекула бар болғаны 0,982 эВ қажет ететін өте ұзақ қозғалған күйге ие. Дәл осы күйде оттегі молекуласы өте химиялық белсенді, бұл өте маңызды ерекшелік және оның салдарымен қызықты, бірақ тиісті мәселелерде, мысалы, химиялық реакциялардың жылдамдығын есептеу кезінде ескеру қажет ерекшелік. осы молекуланы қамтиды.
Сонымен, молекуланың құрамында атомды материалдық нүкте ретінде қарастыруға болады.
Көп атомды молекулалардың айналу және тербеліс еркіндік дәрежелерінің санын есептеуге жеке тоқталайық. Екі атомды молекуланың айналу еркіндік дәрежелерін қарастырудан бастайық. Барлық екі атомды молекулалар түзу сызықты анықтайтын қарапайым себеппен сызықты болып табылады, басқаша айтқанда, екі нүкте әрқашан бір түзудің бойында жатады (1.16-сурет). Күрделі, бірақ сызықты молекулалар да бар, мысалы, көмірқышқыл газының молекуласы сызықты: негізгі күйде (мүмкін болатын энергиясы ең аз) оның үш атомы да бір түзу сызықта жатыр.

Күріш. 1.16. Екі атомды молекула
Әдетте газдың ішкі энергиясын есептегенде сызықтық молекуланың тек оның екі негізгі осінің айналасында, массалар центрі арқылы өтетін және молекула осіне перпендикуляр айналуы ескеріледі; молекуланың оның айналасында айналуы. симметрия осі қарастырылмайды, бұл мүлдем дұрыс. Бірақ осы негізде сызықты молекуланың тек 2 айналу еркіндік дәрежесі бар екендігі айтылған, бұл мүлдем дұрыс емес. Дегенмен, біз осылай жазуды жалғастырамыз, бұл, әрине, түсіндіруді қажет етеді. Айналмалы еркіндік дәрежесінің екі ғана болуы келесі себепке байланысты дұрыс емес. Сызықтық молекула дегеніміз үш өлшемде де шекті өлшемдері бар кеңістіктік түзіліс. Мысалы, молекуладағы ядролардың ара қашықтығы метрге, ал газдың кинетикалық радиусы (модельдегі радиус: молекула – шар) метрге тең. Азот ядроларының радиустары метрге тең. Осыны ескерсек, «Неге ол да өз осінің айналасында айналмауы керек?» деген заңды сұрақ туындайды. Кванттық механика тағы да кінәлі. Кванттық механикалық есептеулер белгілі бір ось айналасында айналуды индукциялау үшін қажетті энергияны көрсетеді кері пропорционал инерция моментіосы оське қатысты. Сондықтан, біз ядролардың айналуын қозғау туралы айтып отырған жоқпыз - бұл «шарлардың» радиусы тым кішкентай, сәйкесінше оларды айналмалы қозғалысқа келтіру үшін қажетті минималды энергия тым үлкен. Бұл тағы да жүздеген килоэлектронвольттар: ядролардың айналу энергиясы деп аталатын деңгейлері. Бір ғана нәрсе қалды: оның электронды қабығын молекула осінің айналасына «орау», бірақ электронды қабық күйінің кез келген өзгерісі 10 эВ ретті энергияны қажет етеді. Атап айтқанда, молекуланы өз осінің айналасында «бұрау» үшін, яғни молекуланы бірінші айналмалы қозған күйге көшіру үшін жетпіс мың градустан асатын температураға сәйкес келетін 7,35 эВ қажет. Осылайша, «газ» температураларында, яғни газ әлі де плазма емес, газ күйінде болған температураларда (бірнеше мың градустан аз), өз осінің айналасында айналатын сызықтық молекулалардың саны шамалы болады.

Күріш. 1.17. Сызықтық молекула
Жалпы жағдай осындай. Көрінетін болмауыМолекула қозғалыстың сәйкес түрлерін қоздыру үшін қажетті энергияға байланысты белгілі бір еркіндік дәрежесіне ие, кванттық себептерге байланысты, аса көп тамаша(кіші емес!, 1.17-сурет). Молекулалардың бір-бірімен соқтығысуы нәтижесінде қозғалыстың бұл түрлері қозатын молекулалар не мүлде жоқ (ақылға қонымды газ мөлшерінде), не олар бар, бірақ салыстырмалы түрде аз мөлшерде болады. қозғалыстың осы түрлерінің газының ішкі энергиясы шамалы. Бұл молекуланың электронды қабатының электрондарымен байланысты барлық еркіндік дәрежелеріне қатысты. Дәл осы себепті молекуладағы оқшауланған атомды да, атомды да материалдық нүкте ретінде қарастыруға болады (1.18-сурет).

Күріш. 1.18. Үш атомды молекула
Жоғарыда айтылғандарды ескере отырып, модель шеңберінде молекуланың еркіндік дәрежелерінің санын анықтау: «атом - материалдық нүкте» келесіге келеді.
Егер молекула атомдардан тұрса – материалдық нүктелер, еркіндік дәрежелері:
Барлығы- , Олардың ішінен:
прогрессивті- 3 әрқашан,
айналмалы- 3 (кеңістіктік молекула) немесе 2 (сызықтық молекула),
тербелмелі- немесе кеңістіктік (сызықтық) молекулалар үшін.
Біз сізге еркіндік дәрежелерін осы ретпен санауды ұсынамыз: барлығы, трансляциялық, айналмалы және қалғандары тербелмелі. Құрылымдық химиялық формулаларға сенбеу керек, олар ядролар топтарының немесе молекуланы құрайтын атомдардың жеке ядроларының белгілі бір тербеліс қозғалыстарының мүмкіндіктерін емес, химиялық байланыстарды көрсетеді. Мысалы, бұралу тербелістерінің мүмкіндігі ешқандай түрде көрсетілмейді. Бұл формулаларды пайдалану көбінесе діріл еркіндік дәрежелерінің санын есептеу кезінде қателіктерге әкеледі. Молекуланың құрылымы туралы бір ғана нәрсе білу керек: ол сызықты ма, жоқ па.
Молекулалардың еркіндік дәрежелерінің санын есептеуге үш мысал келтірейік ![]() . Алдымен біз деп белгілейтін «классикалық санды» енгізейік, ол кейінірек қажет болады:
. Алдымен біз деп белгілейтін «классикалық санды» енгізейік, ол кейінірек қажет болады:
мұнда еркіндіктің трансляциялық дәрежелерінің саны, айналу еркіндік дәрежелерінің саны және еркіндіктің тербеліс дәрежесінің саны. Алдындағы екеуі болғандықтан, бұл сан молекуланың еркіндік дәрежелерінің жалпы санына мүлдем тең емес және олай аталмауы керек.
1.4.1-кесте.
|
Молекула/ Дәрежелер Бостандық; |
сызықтық |
сызықтық |
жалпақ немесе кеңістіктік |
|
|
Прогрессивті |
||||
|
Айналмалы |
||||
|
Тербелмелі |
||||
Этан молекуласының екі тепе-теңдік конфигурациясы бар: бір жағдайда барлық сегіз атом бір жазықтықта жатады; екінші тепе-теңдік конфигурациясында «сол» төрт және «оң» төрттік өзара перпендикуляр орналасқан жазықтықтар. Екі тепе-теңдік конфигурациясында да тепе-теңдік позицияларына жақын атомдары бар бұл жазықтықтардың бұралу тербелісі мүмкін. Атомдардың тербелісі, дәлірек айтсақ, полиатомды молекуланың құрамына кіретін атомдар ядролары молекуланың ішкі қозғалысы болып табылады, сондықтан бұл қозғалысты молекуланың массалар центрі жүйесінде қарастырған ыңғайлы.
Неліктен үш атомды су молекуласының үш діріл дәрежесі бар, ал үш атомды көмірқышқыл газы молекуласының төрт еркіндік дәрежесі бар екенін түсіну үшін молекуладағы ядролардың табиғи тербеліс режимдерін қарастырайық. .
Бұл молекуланың төрт тербеліс режимі келесідей. Симметриялық сән: үш ядро да бір түзу бойында қалады, көміртегі ядросы қозғалыссыз, екі оттегі ядросы антифазада тербеледі, яғни жарты период бойы бір-біріне және көміртек ядросына жақындап, оған қарама-қарсы екі жақтан қозғалады; кезеңнің екінші жартысында олар әлі де антифазада, бір-бірінен және көміртегі ядросынан алыстайды. Асимметриялық сән: барлық үш ядро бір түзу сызықта қалады, екі оттегі ядросы бір бүтін (олардың арасындағы тұрақты қашықтықпен) көміртегі ядросымен антифазада тербеледі. Екі есе азғындау деформация режимі: ядролар бір түзуде тұрмайды; олар түзу сызықта орналасқан тепе-теңдік позицияларынан шыққан сәтте , олар (үшеуі де) осы түзуге перпендикуляр бағытта қозғалады. Салыстырмалы түрде айтсақ, молекуланың осі көлденең болса және көміртегі ядросы жоғары қозғалса, онда оттегінің екі ядросы да төмен қарай жылжиды. Яғни, екі оттегі ядросы бір-бірімен фазада және көміртек ядросымен фазадан тыс тербеледі. Бұл түсінікті: әйтпесе молекуланың массалар центрі қозғалыссыз қалмайды.
Екі қатаң теңекі еселенген деформация режимінің табиғи жиіліктері екі өзара перпендикуляр жазықтықтағы ядролардың қозғалысына сәйкес келеді. Егер екі деформация режимінің тек біреуінің тербелісі қозғалса, онда барлық үш ядро да кеңістікте бекітілген жазықтықта қалады. Егер тербелістер екі өзара перпендикуляр жазықтықта да (екі режимде де) қоздырылса, онда амплитудалары қатаң бірдей екі өзара перпендикуляр тербелістердің қосылуы нәтижесінде барлық үш ядроның траекториялары эллипс, ал амплитудалары мен фазалық ығысулары бірдей болса, олар шеңберлер болып табылады. Сонымен қатар, егер көміртегі ядросы өз эллипсі бойымен «сағат тіліне қарсы» қозғалса, екі оттегі ядросы да бірдей эллипс бойымен «сағат тіліне қарсы» қозғалады. «Қолдау» және «қарсы» сөздері белгілі бір себеппен тырнақшаға алынады: олар шартты, өйткені олар қай жағына қарайтыныңызға байланысты.
Сонымен, молекуланың төрт тербеліс еркіндік дәрежесі тек үш түрлі жиілікке сәйкес келеді, өйткені деформация режимі екі есе азайған.
«Атом – материалдық нүкте» моделі шеңберіндегі кез келген екі атомды молекуланың бір еркіндік дәрежесі бар, ол өте қарапайым қозғалысқа сәйкес келеді: оның екі ядросы арасындағы қашықтық тербеледі. Алайда, көбінесе екі атомды газдың макроскопиялық сипаттамалары, мысалы, оның тұрақты көлемдегі және қысымдағы жылу сыйымдылығы, олардың қатынасы - адиабаталық көрсеткіш және басқалары, бұл молекулалар болмаған сияқты (пайыздық дәлдікпен!) бірдей мәндерге ие болады. тербеліс еркіндік дәрежесі бар. Біз бұл «оқиғаның» біріншіден, барлық молекулалар үшін емес, екіншіден, тек тым жоғары емес температурада, бірнеше жүз кельвиннен аспайтынын атап өтеміз. Бұл жағдай, мысалы, ауада (шамамен 80% азот және 20% оттегі) бөлме температурасында орын алады. ![]() . Молекуланың еркіндік дәрежелерінің саны оның құрамына кіретін газ күйінің параметрлеріне тәуелді бола алмайтыны анық. Бұл сан кеңістіктің үш өлшемділігімен және моделімен анықталады: «атом – материалдық нүкте». Сұрақ: «Не болды?»
. Молекуланың еркіндік дәрежелерінің саны оның құрамына кіретін газ күйінің параметрлеріне тәуелді бола алмайтыны анық. Бұл сан кеңістіктің үш өлшемділігімен және моделімен анықталады: «атом – материалдық нүкте». Сұрақ: «Не болды?»
Азот молекуласындағы ядролық тербелістерді қоздыру үшін оған оттегі молекуласынан кем емес энергия беру керек; олар айтқандай, мұндай жағдайларда «діріл кванты» сәл кішірек, атап айтқанда: . Кванттық механикалық есептеудің алдында біз оның нәтижелерін хабарлаймыз.
Бөлме температурасында ![]() олардың жалпы санынан дірілмен қоздырылған азот молекулаларының үлесі шамамен болады
олардың жалпы санынан дірілмен қоздырылған азот молекулаларының үлесі шамамен болады 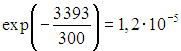 , оттегі үшін бұл фракция шамамен тең
, оттегі үшін бұл фракция шамамен тең  . Осылайша, бөлме температурасындағы ауаның әрбір текше сантиметрінде дірілмен қоздырылған азот молекулалары және тербеліспен қоздырылған оттегі молекулалары үлкен дәрежеде болады. Мұндай жағдайларда бұл молекулаларды «қатты» және тек бес еркіндік дәрежесі бар деп айту қиын, өйткені оларда тербеліс еркіндік дәрежесі жоқ. Оның үстіне қазірдің өзінде 1000 К температурада дірілмен қоздырылған молекулалардың үлесі азот үшін шамамен 3% және оттегі үшін шамамен 10% болады. Басқа мысал ретінде оның ядроларының тербелістерін қоздыру үшін энергияның ең аз мөлшері қажет болатын молекуланы қарастырайық. Бөлме температурасында діріл қоздыратын молекулалардың үлесі шамамен 20% болады. Бұл молекуладағы ядролардың тербелісін бөлме температурасында да елемеуге болмайды.
. Осылайша, бөлме температурасындағы ауаның әрбір текше сантиметрінде дірілмен қоздырылған азот молекулалары және тербеліспен қоздырылған оттегі молекулалары үлкен дәрежеде болады. Мұндай жағдайларда бұл молекулаларды «қатты» және тек бес еркіндік дәрежесі бар деп айту қиын, өйткені оларда тербеліс еркіндік дәрежесі жоқ. Оның үстіне қазірдің өзінде 1000 К температурада дірілмен қоздырылған молекулалардың үлесі азот үшін шамамен 3% және оттегі үшін шамамен 10% болады. Басқа мысал ретінде оның ядроларының тербелістерін қоздыру үшін энергияның ең аз мөлшері қажет болатын молекуланы қарастырайық. Бөлме температурасында діріл қоздыратын молекулалардың үлесі шамамен 20% болады. Бұл молекуладағы ядролардың тербелісін бөлме температурасында да елемеуге болмайды.
Екі атомды молекулада тербеліс еркіндік дәрежесінің болуы немесе болмауы молекуланың түріне және газдың температурасына байланысты деп айту қисынды емес. Бұл кванттық сипатқа ие ядролардың тербеліс қозғалысын бұл жағдайда жеткіліксіз классикалық (кванттық емес) сипаттама шеңберіне «итеру» әрекеті. Екі атомды молекуланың әрқашан тербеліс еркіндік дәрежесі болады, бірақ мұндай молекуладағы ядролардың тербеліс қозғалысының газдың ішкі энергиясына, жылу сыйымдылығына және газдың адиабаталық көрсеткішіне және басқа сипаттамаларына қосқан үлесі болуы мүмкін. теңсіздік орындалса, шамалы
![]()
жоғарыда енгізілген Больцман тұрақтысы мұндағы. Қарама-қарсы теңсіздік орындалғанда
Ядролардың тербеліс қозғалысын елемеуге болмайды. Молекулалардағы ядролардың тербеліс қозғалысының классикалық (кванттық емес) сипаттамасы діріл қозғалысының қозу энергиясы төмен және жеткілікті жоғары температура жағдайында ғана мүмкін болады, атап айтқанда: теңсіздік кезінде.
![]() ,
,
бұл іс жүзінде молекула сияқты сирек ерекше жағдайларда ғана жүзеге асырылады. Біз салыстырмалы түрде ыңғайлы тыныс алатын ауада, молекулалардағы ядролардың тербелісін классикалық механика сипаттамайды.
Енді идеал газға оралайық. Молекулалардың ілгерілемелі қозғалысының орташа кинетикалық энергиясы тең екенін көрдік
![]()
және бұл трансляциялық қозғалыс үш еркіндік дәрежесіне сәйкес келеді. Бұл термодинамикалық тепе-теңдік күйінде еркіндік дәрежесіне орташа энергия бар дегенді білдіреді
Классикалық (кванттық емес) сипаттамамен қозғалыстың барлық түрлері тең. Молекулалар соқтығысады және бұл жағдайда трансляциялық қозғалыс энергиясы айналу қозғалысының энергиясына айналуы оңай болуы мүмкін. Демек, еркіндіктің айналу дәрежесінің әрқайсысында орта есеппен бірдей энергия мөлшері болуы керек -
Бұл мәлімдеме ретінде белгілі Больцманның энергияның еркіндік дәрежелері бойынша тең бөлінуі туралы заңы.Сол сияқты молекулалардың соқтығысуы олардағы ядролардың тербеліс қозғалыстарын тудыруы мүмкін, сондықтан тең бөлудің классикалық заңы молекулалардың тербеліс еркіндік дәрежелеріне де қатысты. Бірақ бұл жерде бір нәзіктік бар. Егер ілгерілемелі және айналмалы қозғалыстарға тек кинетикалық энергия ғана сәйкес келсе, онда гармоникалық осциллятор (бір дірілді еркіндік дәрежесі) орташа алғанда қатаң тең кинетикалық және потенциалдық энергияға ие болады. Сондықтан орта есеппен термодинамикалық тепе-теңдік күйінде тербелмелі қозғалыстың классикалық сипаттамасын қолдану жағдайларында, бір діріл еркіндік дәрежесіне екі есе үлкен энергия бар; бұл көп атомды молекуланың тербеліс дәрежесінің номиналды саны мүлдем емес, онда бір молекуланың орташа энергиясы тең болады
біз келесі тарауда кездесеміз, онда бұл терминнің мағынасы айқынырақ болады. Жоғарыда көрсетілгендей, молекулалардағы ядролардың тербеліс қозғалысы жеткілікті жоғары температураға жеткенде ғана қозғалады ( T > 1000 К), сондықтан қарапайым (бөлмеге жақын) температурада көптеген молекулалар үшін олардың газдың ішкі энергиясына қосқан үлесі шамалы, біз оны есепке алмаймыз, яғни басқаша айтылмасадеп есептейміз
![]() ,
,
мұндағы және молекуланың құрылымына сәйкес трансляциялық (әрдайым 3) және айналмалы (3 немесе 2) еркіндік дәрежелерінің номиналды санына тең.
Мысал.Көлемі бар бөлмеде 75 м 3Температурада екі атомды газ (ауа) бар t = 12 °C (T = 285 К). Қыздырғышты қосып, ауа температурасын дейін көтеріңіз t 2 = 22 °C (T 2 = 295 К). Бөлме тығыздалмағандықтан, газ қысымы тұрақты және барлық уақытта бірдей болып қалады 100 кПа. Бөлмедегі газдың ішкі энергиясының өзгерісін тауып, қоршаған ортаны жылытуға қанша энергия жұмсалғанын анықтайық.
Жауап біршама күтпеген: (1.19) сәйкес бөлмедегі газдың ішкі энергиясы өзгерген жоқ, өйткені оның қысымы да, көлемі де өзгеріссіз қалды. Екінші жағынан, газдың бір бөлігі бөлмеден шығып кетті: егер алдымен оның құрамында болса
Ішкі энергия абсолютті температураға пропорционал болғандықтан, жабық бөлмені жылытқаннан кейін бұл шығады

яғни энергия пештен алынады
Екінші кезеңде біз бөлмеден шығарамыз 3,39 % қыздырылған ауа және онымен бірге энергияның бірдей үлесі. Энергия жойылды
пештен алынған энергияға тура тең. Басқаша біз тағы да сол тұжырымға келдік.
Сонымен, көшеге шыққан ауа пештен алынған барлық энергияны өзімен бірге алып кеткені ақыры белгілі болды. Сонда пештің рөлі қандай? Тек көшені жылытатын болса, оны қосудың қажеті бар ма? Пештің пайдалы әсері 12 градус температурада адамның қоршаған ауаға жылу жоғалтуы соншалықты көп (киінгеніне қарамастан, болжауға болады), дененің терморегуляция жүйесі қалыпты температураны ұстап тұруда қиындықтарға тап болады. және мынаны білдіреді: бұл суық адам, ыңғайсыз! Ал 22 градус температурада жылуды жоғалту айтарлықтай аз, терморегуляция жүйесіне жүктеме аз - адам өзін өте ыңғайлы сезінеді және жылытқышты қосуды қаламайды.
қосымша ақпарат
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - Дж. де Бур Молекулярлық физика мен термодинамикаға кіріспе, ред. IL, 1962 - 50–61 б., I бөлім, § 6, - жылу сыйымдылықтарының теориялық есебі, он меншікті газ үшін кең температуралық диапазондағы тұрақты көлемдегі жылу сыйымдылығының тәжірибелік тәуелділіктері келтірілген.
Өрнектерді салыстырайық
Термодинамикалық температура – молекулалардың ілгерілемелі қозғалысының орташа энергиясына пропорционал шама.
Тек газ молекулалары үдемелі қозғалады, сұйық және қатты денелердегі молекулалардың қозғалысы басқа сипатта болады.
Молекулалардың орташа энергиясы тек температураға тәуелді және молекуланың массасына тәуелді емес екендігі маңызды.
Таныстыру ![]() , және салыстыру
, және салыстыру ![]() , Біз алып жатырмыз:
, Біз алып жатырмыз:
|
|
(43 .3 ) |
Шаманың квадрат түбірі деп аталады молекулалардың орташа квадраттық жылдамдығы. Тек бір атомды молекулалар ғана алға жылжиды. Екі және көп атомды молекулалар трансляциялық қозғалыстан басқа айналмалы және тербеліс қозғалыстарын да орындай алады. Қозғалыстың бұл түрлері классикалық физика (яғни Ньютон заңдары негізінде) және статистикалық физика белгілеген молекуланың еркіндік дәрежелері бойынша энергияның тең таралу заңымен есептелуі мүмкін белгілі бір энергия мөлшерімен байланысты.
Механикалық жүйенің еркіндік дәрежелерінің саны ұғымын енгізейік.
Механикалық жүйенің еркіндік дәрежелерінің саны - бұл жүйенің кеңістіктегі орнын анықтауға болатын тәуелсіз шамалардың саны.
Материалдық нүктенің кеңістіктегі орны оның үш координатасының мәндерімен анықталады, мысалы, декарттық координаталар x, y, z немесе сфералық координаталар r, θ, φ және т.б. Осыған сәйкес материалдық нүкте бар үшеркіндік дәрежелері.
Абсолют қатты дененің (АРБ) орнын оның массалар центрінің x, y, z координаталары және дененің кеңістіктегі бағытын көрсететін θ, φ және ψ бұрыштары арқылы анықтауға болады.

С массалар центрінің координаталары x, y, z тұрақты анықтамалық жүйеде анықталады. Көмекші координаталық осьтер x´, y´, z´ денемен бірге трансляциялық қозғалады. Өзара перпендикуляр AA және BB осьтері денеге қатаң түрде қосылған. A´A´ түзу AA осінің x´ z´ жазықтығына проекциясы. φ және υ бұрыштары AA және A`A` осінің кеңістігіндегі бағдарын анықтайды. θ бұрышы жарылыс осінің бағытын анықтайды.
Демек, абсолютті қатты дене бар алтыеркіндік дәрежелері. Дененің ілгерілемелі қозғалысы кезінде тек массалар центрінің координаталары өзгереді, ал θ, φ және ψ бұрыштары өзгеріссіз қалады. Сондықтан сәйкес еркіндік дәрежелері деп аталады прогрессивті. (Материалдық нүктенің үш еркіндік дәрежесі трансляциялық екені анық.) Дененің айналуымен байланысты еркіндік дәрежелері деп аталады. айналмалы. Мысалы, θ, φ және ψ бұрыштарының қозғалмайтын масса центрі бар өзгерістері, дененің айналуына байланысты. Сонымен абсолютті қатты дененің алты еркіндік дәрежесінің үшеуі трансляциялық, үшеуі айналмалы.
N материалдық нүктелер жүйесі, олардың арасында қатаң байланыстар жоқ. 3N еркіндік дәрежесі бар (әр нүктенің орны үш координатпен анықталады). Екі нүкте арасындағы тұрақты қашықтықты анықтайтын әрбір қатаң байланыс еркіндік дәрежесінің санын бір азайтады. Мысалы, серпімді байланысы бар екі материалдық нүктелер жүйесі үш ілгерілемелі, екі айналмалы және бір тербеліс еркіндік дәрежесіне ие.
Молекулалардың еркіндік дәрежелерінің санын анықтаған кезде атомдарды материалдық нүктелер ретінде қарастыру керек екені тәжірибе жүзінде анықталған. Тиісінше, бір атомды молекулаға еркіндіктің үш трансляциялық дәрежесі тағайындалуы керек. Атомдар арасындағы қатаң байланысы бар екі атомды молекулаға бес еркіндік дәрежесі тағайындалуы керек - үш трансляциялық және екі айналмалы.
Молекуланың еркіндік дәрежелерінің кез келген саны үшін олардың үшеуі трансляциялық болып табылады және олардың ешқайсысының басқаларынан артықшылығы жоқ.. Демек, еркіндіктің трансляциялық дәрежесінің әрқайсысының энергиясы орташа алғанда (kT/2) тең, ал барлық үш ілгерілемелі еркіндік дәрежесінің энергиясы орташа алғанда (3kT/2) тең.
бойынша тең бөлу заңы бойынша еркіндіктің кез келген дәрежесі(трансляциялық, айналмалы және тербелмелі) жылы орташа алғанда бірдей кинетикалық энергия бар, теңкТ/2.
Гармоникалық тербелістерді (синусоидалы немесе косинус) орындайтын жүйе деп аталады гармоникалық осциллятор.
Тербелмелі қозғалыс (мысалы, маятниктің тербелісі) тербелмелі жүйеде тек кинетикалық емес, потенциалдық энергияның болуымен байланысты. Тербеліс теориясында гармоникалық осциллятордың кинетикалық және потенциалдық энергияларының орташа мәндері бірдей болатыны дәлелденген. Бұдан шығатыны, молекуланың дірілдік еркіндік дәрежесі ілгерілемелі немесе айналмалымен салыстырғанда екі есе артық – әрбір діріл еркіндік дәрежесі үшін орта есеппен кТ екі жартысы болады, біреуі кинетикалық энергия түрінде және екіншісі потенциалдық энергияның түрі.
Кинетикалық энергияның еркіндік дәрежелері бойынша тең таралу заңынан молекуланың орташа энергиясы формула бойынша анықталатыны шығады.
Молекулярлық қозғалыстың табиғаты туралы классикалық идеялар негізінде тең бөлу заңы алынды. Сондықтан ол шамамен алынған және кванттық әсерлер маңызды болған жағдайларда бұзылады.





