Електрически ток в газове
Носители на заряд: електрони, положителни йони, отрицателни йони.
Носителите на заряд възникват в газ в резултат на йонизация: поради облъчване на газа или сблъсък на частици от нагрят газ един с друг.
Йонизация с електронен удар.
A_ (полета) = eEl
e = 1,6 \ cdot 10 ^ (19) Cl;
E е посоката на полето;
l е средният свободен път между два последователни сблъсъка на електрон с газови атоми.
A_ (полета) = eEl \ geq W - йонизационно условие
W е йонизационната енергия, т.е. енергия, необходима за изтръгването на електрон от атома

Броят на електроните нараства експоненциално, което води до електронна лавина и следователно до разряд в газа.
Електрически ток в течност
Течностите, точно като твърдите тела, могат да бъдат диелектрици, проводници и полупроводници. Дестилираната вода е сред диелектриците, а разтворите на електролити: киселини, основи, соли и метални стопилки са проводници. Течните полупроводници са стопилки на селен и сулфид.
Електролитна дисоциация
Когато електролитите се разтварят под въздействието на електрическото поле на полярните водни молекули, молекулите на електролита се разлагат на йони. Например, CuSO_ (4) \ дясна стрелка Cu ^ (2 +) + SO ^ (2 -) _ (4).
Заедно с дисоциацията протича и обратният процес - рекомбинация , т.е. комбиниране на йони с противоположни знаци в неутрални молекули.
Носителите на електричество в електролитните разтвори са йони. Тази проводимост се нарича йонна .
Електролиза
Ако електродите се поставят във вана с електролитен разтвор и се приложи ток, тогава отрицателните йони ще се придвижат към положителния електрод, а положителните йони към отрицателния.
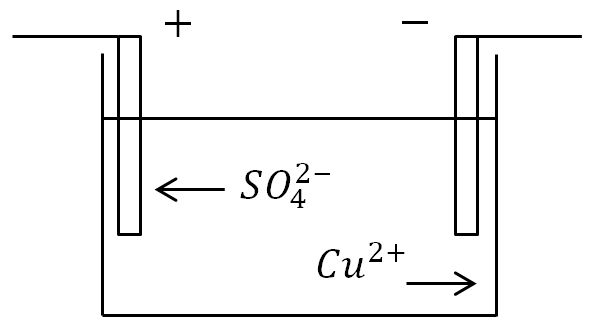
На анода (положителен електрод) отрицателно заредените йони даряват излишни електрони (окислителна реакция), а на катода (отрицателен електрод), положителните йони получават липсващи електрони (реакция на редукция).
Определение.Процесът на освобождаване на вещества върху електродите, свързан с редокс реакции, се нарича електролиза.
Законите на Фарадей
аз Масата на веществото, което се отделя от електрода, е право пропорционална на заряда, протичащ през електролита:
m = kq
k е електрохимичният еквивалент на веществото.
q = I \ Delta t, тогава
m = kI \ Delta t
k = \ frac (1) (F) \ frac (\ mu) (n)
\ frac (\ mu) (n) - химичен еквивалент на вещество;
\ mu - моларна маса;
n - валентност
Електрохимичните еквиваленти на веществата са пропорционални на химичните.
F е константата на Фарадей;
Произходът на електрическия ток (движение на електрически заряди) през разтвор е значително различен от движението на електрически заряди по метален проводник.
Разликата на първо място е, че носителите на заряд в разтворите не са електрони, а йони, т.е. самите атоми или молекули, които са загубили или уловили един или повече електрони.
Естествено, това движение, по един или друг начин, е придружено от промяна в свойствата на самото вещество.
Помислете за електрическа верига, чийто елемент е съд с разтвор на натриев хлорид и с електроди с всякаква форма от поставена в него плоча. При свързване към източник на захранване във веригата се появява ток, който представлява движението на тежки заредени частици - йони в разтвора. Появата на йони вече означава възможността за химическо разлагане на разтвора на два основни елемента - Na и Cl. Натрият, който е загубил електрон, е положително зареден йон, движещ се към електрод, който е свързан към отрицателния полюс на източник на енергия, електрическа верига. Хлорът, който "узурпира" един електрон, е отрицателен йон.
Отрицателните хлорни йони се придвижват към електрода, който е свързан към положителния полюс на източника на енергия. вериги.
Образуването на положителни и отрицателни йони се дължи на спонтанното разлагане на молекулата на солта във воден разтвор (електролитна дисоциация). Движението на йони се причинява от напрежението, приложено към електродите, потопени в разтвора. Достигайки до електродите, йоните поемат или даряват електрони, образувайки съответно Cl и Na молекулите. Подобни явления се наблюдават в разтвори на много други вещества. Молекулите на тези вещества, подобно на молекулите на готварската сол, се състоят от противоположно заредени йони, на които се разлагат в разтвори. Броят на дезинтегрираните молекули, по-точно броят на йоните, характеризира електрическото съпротивление на разтвора.
Още веднъж подчертаваме, че възникването на електрически ток по веригата, чийто елемент е разтвор, причинява движение на веществото на този елемент от електрическа верига и следователно промяна в неговите химични свойства, докато по време на преминаването на електрически ток през метален проводник, без промени в проводника.
Какво определя количеството вещество, отделено по време на електролизата върху електродите? Фарадей беше първият, който отговори на този въпрос. Фарадей показа експериментално, че масата на освободеното вещество е свързана със силата на тока и времето на неговото протичане t чрез съотношението (законът на Фарадей):
Масата на освободеното вещество по време на електролизата на веществото е право пропорционална на количеството електричество, преминало през електролита, и не зависи от други причини, освен от вида на веществото.
Този модел може да бъде проверен в следните експерименти. Изсипете един и същ електролит в няколко бани, но с различни концентрации. Нека поставим електроди с различни области във ваните и да ги поставим във ваните на различни разстояния. Свързваме всички бани последователно и оставяме тока да тече през тях. Тогава, очевидно, същото количество електричество ще премине през всяка от баните. След като претеглихме катодите преди и след експеримента, установяваме, че едно и също количество вещество се отделя на всички катоди. Чрез свързване на всички бани успоредно и преминаване на ток през тях, можете да се уверите, че количеството вещество, освободено от катодите, е право пропорционално на количеството електричество, преминало през всяка от тях. И накрая, чрез последователно свързване на вани с различни електролити, е лесно да се установи, че количеството на освободеното вещество зависи от вида на това вещество.
Стойността, характеризираща зависимостта на количеството на веществото, освободено по време на електролиза от неговия вид, се нарича електрохимичен еквивалент и се обозначава с буквата k.
Масата на веществото, освободено по време на електролизата, е общата маса на всички йони, изхвърлени от електрода. Подлагайки различни соли на електролиза, може експериментално да се установи количеството електричество, което трябва да премине през електролита, за да се освободи един килограм – еквивалент на дадено вещество. Такива експерименти са извършени за първи път от Фарадей. Той установи, че освобождаването на един килограм - еквивалент на всяко вещество по време на електролиза изисква същото количество електричество, равно на 9,65 107 K.
Количеството електричество, необходимо за освобождаване на килограм еквивалент на вещество по време на електролиза, се нарича числото на Фарадей и се обозначава с буквата F:
F = 9,65 107 k.
В електролит един йон е заобиколен от молекули на разтворител (вода) със значителни диполни моменти. Взаимодействайки с йон, диполните молекули се обръщат към него със своите краища, които имат заряд, противоположен на заряда на йона; следователно, правилното движение на йона в електрическо поле е затруднено и подвижността на йоните е значително по-ниска на подвижността на електроните на проводимостта в метала. Тъй като концентрацията на йони обикновено не е висока в сравнение с концентрацията на електрони в метал, електрическата проводимост на електролитите винаги е значително по-малка от електрическата проводимост на металите.
Поради силното нагряване от ток в електролитите са постижими само незначителни плътности на тока, т.е. ниска сила на електрическото поле. С повишаване на температурата на електролита подредената ориентация на диполите на разтворителя се влошава под въздействието на повишеното произволно движение на молекулите, поради което диполната обвивка се разрушава частично, подвижността на йоните и проводимостта на разтвора се увеличават. Зависимостта на специфичната електрическа проводимост от концентрацията при постоянна температура е сложна. Ако е възможно разтваряне във всякакви пропорции, тогава при определена концентрация електрическата проводимост има максимум. Причината за това е следната: вероятността за разлагане на молекулите на йони е пропорционална на броя на молекулите на разтворителя и на броя на молекулите на разтворимото вещество на единица обем. Но е възможен и обратният процес: (рекомбинация на йони в молекули), чиято вероятност е пропорционална на квадрата на броя на йонните двойки. И накрая, електрическата проводимост е пропорционална на броя на йонните двойки на единица обем. Следователно при ниски концентрации дисоциацията е пълна, но общият брой йони е малък. При много високи концентрации дисоциацията е слаба и броят на йоните също е малък. Ако разтворимостта на веществото е ограничена, тогава обикновено максималната електрическа проводимост не се наблюдава. При замръзване вискозитетът на водния разтвор рязко се увеличава, подвижността на йоните рязко намалява и специфичната електрическа проводимост пада хиляди пъти. Когато течните метали се втвърдяват, подвижността на електроните и електрическата проводимост почти не се променят.
Електролизата се използва широко в различни електрохимични индустрии. Най-важните от тях: електролитно производство на метали от водни разтвори на техните соли и от техните стопени соли; електролиза на хлоридни соли; електролитно окисление и редукция; получаване на водород чрез електролиза; галванопластика; електротип; електрополиране. Чрез рафиниране се получава чист метал, пречистен от примеси. Галванопластика - покриване на метални предмети с друг слой метал. Галванопластика - получаване на метални копия от релефни изображения на всякакви повърхности. Електрополиране - изравняване на метални повърхности.
« Физика - 10 клас
Кои са носителите на електрически ток във вакуум?
Какъв е характерът на тяхното движение?
Течностите, подобно на твърдите тела, могат да бъдат диелектрици, проводници и полупроводници. Диелектриците включват дестилирана вода, проводници - разтвори и стопилки на електролити: киселини, основи и соли. Течните полупроводници са разтопен селен, сулфидни стопилки и др.
Електролитна дисоциация.
Когато електролитите се разтварят под въздействието на електрическото поле на полярните водни молекули, молекулите на електролита се разлагат на йони.
Разпадането на молекулите на йони под въздействието на електрическото поле на полярните водни молекули се нарича електролитна дисоциация.
Степен на дисоциация- съотношението в разтвореното вещество на молекулите, които са се разпаднали на йони.
Степента на дисоциация зависи от температурата, концентрацията на разтвора и електрическите свойства на разтворителя.
С повишаване на температурата степента на дисоциация се увеличава и следователно концентрацията на положително и отрицателно заредени йони се увеличава.
Йоните с различни знаци, когато се срещнат, могат отново да се комбинират в неутрални молекули.
При непроменени условия в разтвора се установява динамично равновесие, при което броят на молекулите, които се разпадат на йони за секунда, е равен на броя на двойките йони, които отново се комбинират в неутрални молекули за същото време.
Йонна проводимост.
Носители на заряд във водни разтвори или разтопени електролити са положително и отрицателно заредени йони.
Ако съд с електролитен разтвор е включен в електрическа верига, тогава отрицателните йони ще започнат да се движат към положителния електрод - анода, а положителните йони - към отрицателния - към катода. В резултат на това през веригата ще тече електрически ток.
Проводимостта на водни разтвори или електролитни стопилки, която се осъществява от йони, се нарича йонна проводимост.
Електролиза.При йонната проводимост преминаването на ток е свързано с преноса на материя. Върху електродите се осъществява отделянето на вещества, които съставляват електролитите. На анода отрицателно заредените йони дават своите допълнителни електрони (в химията това се нарича окислителна реакция), а на катода положителните йони получават липсващите електрони (реакция на редукция).
Течностите също могат да бъдат електронно проводими. Такава проводимост имат например течните метали.
Нарича се процесът на освобождаване от електрода на вещество, свързано с редокс реакции електролиза.
Какво определя масата на веществото, освободено за определено време? Очевидно масата m на освободеното вещество е равна на произведението на масата m 0i на един йон на броя N i йони, достигнали до електрода за времето Δt:
m = m 0i N i. (16.3)
Масата на йона m 0i е равна на:
където M е моларната (или атомната) маса на веществото, а N A е константата на Авогадро, тоест броят на йоните в един мол.
Броят на йоните, достигащи до електрода е
където Δq = IΔt е зарядът, преминал през електролита за времето Δt; q 0i е зарядът на йона, който се определя от валентността n на атома: q 0i = ne (e е елементарният заряд). По време на дисоциацията на молекули, например KBr, състоящи се от едновалентни атоми (n = 1), се появяват йони K + и Br -. Дисоциацията на молекулите на медния сулфат води до появата на двойно заредени йони Cu 2+ и SO 2-4 (n = 2). Замествайки изрази (16.4) и (16.5) във формула (16.3) и като вземем предвид, че Δq = IΔt, a q 0i = ne, получаваме
Законът на Фарадей.
Нека обозначим с k коефициента на пропорционалност между масата m на веществото и заряда Δq = IΔt, преминал през електролита:
където F = eN A = 9,65 10 4 C / mol - Константа на Фарадей.
Коефициентът k зависи от естеството на веществото (стойности на M и n). Съгласно формула (16.6) имаме
m = kIΔt. (16.8)
Законът за електролизата на Фарадей:
Масата на веществото, освободено от електрода за времето Δt. с преминаването на електрически ток, той е пропорционален на силата на тока и времето.
Това твърдение, получено теоретично, е установено за първи път експериментално от Фарадей.
Количеството k във формула (16.8) се нарича електрохимичен еквивалентот това вещество и се изразява в килограми на висулка(kg/Cl).
От формулата (16.8) се вижда, че коефициентът k е числено равен на масата на веществото, освободено върху електродите при пренасяне на заряд, равен на 1 C от йони.

Електрохимичният еквивалент има просто физическо значение. Тъй като M / N A = m 0i и en = q 0i, то съгласно формула (16.7) k = rn 0i / q 0i, тоест k е съотношението на масата на йона към неговия заряд.
Чрез измерване на стойностите на m и Δq е възможно да се определят електрохимичните еквиваленти на различни вещества.
Можете да се убедите в валидността на закона на Фарадей чрез опит. Нека сглобим инсталацията, показана на фигура (16.25). И трите електролитни вани са пълни с един и същ електролитен разтвор, но токовете, преминаващи през тях, са различни. Да обозначим силата на токовете през I1, I2, I3. Тогава I 1 = I 2 + I 3. Чрез измерване на масите m 1, m 2, m 3 на веществата, отделяни върху електродите в различни вани, може да се уверите, че те са пропорционални на съответните сили на токовете I 1, I 2, I 3.
Определяне на заряда на електрона.
Формула (16.6) за масата на веществото, освободено върху електрода, може да се използва за определяне на заряда на електрона. От тази формула следва, че модулът на заряда на електрона е равен на:
Познавайки масата m на освободеното вещество по време на преминаването на заряда IΔt, моларната маса M, валентността на n атома и константата на Авогадро N A, можем да намерим стойността на модула на заряда на електрона. Оказва се, че е равно на e = 1,6 10 -19 C.
Именно по този начин стойността на елементарния електрически заряд е получена за първи път през 1874 г.
Приложение за електролиза.Електролизата се използва широко в технологиите за различни цели. Покрийте електролитно повърхността на един метал с тънък слой от друг ( никелиране, хромиране, позлатяванеи др.). Това трайно покритие предпазва повърхността от корозия. Ако осигурите добро отлепване на електролитното покритие от повърхността, върху която е отложен металът (това се постига например чрез нанасяне на графит върху повърхността), тогава можете да получите копие от релефната повърхност.
Процесът на получаване на белещи се покрития - електротип- е разработен от руския учен Б. С. Якоби (1801-1874), който през 1836 г. прилага този метод за изработване на кухи фигури за Исакиевската катедрала в Санкт Петербург.
Преди това в печатарската индустрия копия от релефна повърхност (стереотипи) се получават от матрици (отпечатък на комплект върху пластмасов материал), за които върху матрицата се отлага дебел слой желязо или друго вещество. Това направи възможно възпроизвеждането на комплекта в необходимия брой копия.
С помощта на електролиза металите се пречистват от примеси. Така суровата мед, получена от рудата, се отлива под формата на дебели листове, които след това се поставят във вана като аноди. По време на електролизата медта на анода се разтваря, примесите, съдържащи ценни и редки метали, падат на дъното, а чистата мед се утаява на катода.
С помощта на електролиза алуминият се получава от стопилка на боксит. Именно този метод за производство на алуминий го направи евтин и заедно с желязото най-разпространен в технологиите и ежедневието.
С помощта на електролизата се получават електронни платки, които служат за основа на всички електронни продукти. Върху диелектрика е залепена тънка медна плоча, върху която със специална боя се нанася сложен модел от свързващи проводници. След това плочата се поставя в електролит, където се ецват участъци от медния слой, непокрити с боя. След това боята се измива и детайлите на микросхемата се появяват на дъската.
Течностите, подобно на твърдите тела, могат да бъдат проводници, полупроводници и диелектрици. Този урок се фокусира върху проводими течности. И не за течности с електронна проводимост (разтопени метали), а за течности-проводници от втори вид (разтвори и стопилки на соли, киселини, основи). Типът проводимост на такива проводници е йонен.
Определение... Проводници от втория вид са такива проводници, в които протичат химични процеси при протичане на ток.
За по-добро разбиране на процеса на провеждане на тока в течности може да си представим следния експеримент: Два електрода бяха поставени във водна вана, свързани към източник на ток; във веригата можете да вземете електрическа крушка като индикатор за ток . Ако затворите такава верига, лампата няма да изгори, което означава, че няма ток, което означава, че има прекъсване на веригата, а самата вода не провежда ток. Но ако поставите определено количество готварска сол в банята и повторите затварянето, светлината ще светне. Това означава, че свободните носители на заряд, в случая йони, започват да се движат във ваната между катода и анода (фиг. 1).

Ориз. 1. Схема на експеримента
Електролитна проводимост
Откъде идват безплатните такси във втория случай? Както беше споменато в един от предишните уроци, някои диелектрици са полярни. Водата има точно същите полярни молекули (фиг. 2).

Ориз. 2. Полярността на водната молекула
Когато се добави сол към водата, водните молекули са ориентирани по такъв начин, че техните отрицателни полюси са близо до натрий, а положителните са близо до хлор. В резултат на взаимодействието между зарядите, водните молекули разбиват молекулите на солта на двойки различни йони. Натриевият йон има положителен заряд, хлорният йон е отрицателен (фиг. 3). Именно тези йони ще се движат между електродите под действието на електрическо поле.

Ориз. 3. Схема на образуване на свободни йони
Когато натриевите йони се приближат до катода, той получава своите липсващи електрони, докато хлорните йони, когато достигнат до анода, се отказват от своите.
Електролиза
Тъй като протичането на тока в течности е свързано с преноса на материя, с такъв ток протича процесът на електролиза.
Определение.Електролизата е процес, свързан с окислително-редукционни реакции, при които вещество се отделя върху електродите.
Веществата, които в резултат на такива разцепвания осигуряват йонна проводимост, се наричат електролити. Това име е предложено от английския физик Майкъл Фарадей (фиг. 4).
Електролизата прави възможно получаването на вещества от разтвори в достатъчно чиста форма, поради което се използва за получаване на редки материали като натрий, калций ... в чиста форма. Това се прави от така наречената електролитна металургия.
Законите на Фарадей
В първата си работа върху електролизата през 1833 г. Фарадей представя своите два закона за електролизата. Първият се занимава с масата на веществото, отделено върху електродите:
Първият закон на Фарадей гласи, че тази маса е пропорционална на заряда, преминал през електролита:
Тук ролята на коефициента на пропорционалност играе количеството – електрохимичния еквивалент. Това е таблична стойност, която е уникална за всеки електролит и е основната му характеристика. Размер на електрохимичния еквивалент:
![]()
Физическото значение на електрохимичния еквивалент е масата, освободена върху електрода, когато количеството електричество в 1 C преминава през електролита.
Ако си спомняте формулите от темата за постоянен ток:
Тогава можете да представите първия закон на Фарадей във формата:
Вторият закон на Фарадей пряко засяга измерването на електрохимичния еквивалент чрез други константи за даден електролит:
Тук: - моларна маса на електролита; - елементарен заряд; - валентност на електролита; е числото на Авогадро.
Количеството се нарича химичен еквивалент на електролита. Тоест, за да се знае електрохимичният еквивалент, достатъчно е да се знае химическият еквивалент, останалите формули са световни константи.
Въз основа на втория закон на Фарадей, първият закон може да бъде представен като:
![]()
Фарадей предложи терминология за тези йони по отношение на електрода, към който се придвижват. Положителните йони се наричат катиони, защото се движат към отрицателно заредения катод, отрицателните заряди се наричат аниони, докато се движат към анода.
Описаното по-горе действие на водата за разграждане на молекула на два йона се нарича електролитна дисоциация.
Освен разтвори, стопилките могат да бъдат и проводници от втория вид. В този случай наличието на свободни йони се постига от факта, че при високи температури започват много активни молекулни движения и вибрации, в резултат на което настъпва разрушаването на молекулите в йони.
Практическо приложение на електролизата
Първото практическо приложение на електролизата се случва през 1838 г. от руския учен Якоби. С помощта на електролиза той получава отпечатък на фигури за Исакиевския събор. Това приложение на електролизата се нарича електроформоване. Друга област на приложение е галваничното покритие - покриване на един метал с друг (хромиране, никелиране, златно покритие и др., фиг. 5)
- Fatyf.narod.ru ().
- Химия ().
- Ens.tpu.ru ().
Домашна работа
- Какво представляват електролитите?
- Кои са двата фундаментално различни вида течности, в които може да тече електрически ток?
- Какви са механизмите за образуване на свободни носители на заряд?
- * Защо масата, освободена от електрода, е пропорционална на заряда?