Одним из первых типов химических соединений, изучаемых в школьной программе по органической химии, являются алканы. Они относятся к группе предельных (иначе - алифатических) углеводородов. В их молекулах присутствуют только одинарные связи. Атомам углерода свойственна sp³-гибридизация.
Гомологами называют химические вещества, которые имеют общие свойства и химическое строение, но при этом отличающиеся на одну или несколько CH2-групп.
В случае с метаном CH4 можно привести общую формулу для алканов: CnH (2n+2), где n - это количество атомов углерода в соединении.
Приведём таблицу алканов, в которых n находится в пределах от 1 до 10.
Изомерия алканов
Изомерами называют те вещества, молекулярная формула которых совпадает, однако строение или структура отличается.
Для класса алканов характерны 2 типа изомерии: углеродного скелета и оптическая изомерия.
Приведём пример структурного изомера (т. е. вещества, отличающимся лишь строением углеродного скелета) для бутана C4H10.
Оптическими изомерами называют такие 2 вещества, молекулы которых имеют похожую структуру, но не могут быть совмещены в пространстве. Явление оптической или зеркальной изомерии возникает у алканов, начиная с гептана C7H16.
Чтобы дать алкану правильное название, необходимо воспользоваться номенклатурой ИЮПАК . Для этого использоваться следующая последовательность действий:

По приведённому выше плану попробуем дать название следующему алкану.

 В обычных условиях неразветвленные алканы с CH4 до C4H10 - это газообразные вещества, начиная с С5Н12 и до C13H28 - жидкие и обладающие специфическим запахом, все последующие - твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления
. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
В обычных условиях неразветвленные алканы с CH4 до C4H10 - это газообразные вещества, начиная с С5Н12 и до C13H28 - жидкие и обладающие специфическим запахом, все последующие - твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления
. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
Газообразные алканы не обладают цветом. А также все представители этого класса не могут растворяться в воде.
Алканы, имеющие агрегатное состояние газа, могут гореть , при этом пламя будет либо бесцветным, либо обладать бледно-голубым оттенком.
Химические свойства
В обычных условиях алканы достаточно малоактивны. Это объясняется прочностью σ-связей между атомами C-C и C-H. Поэтому необходимо обеспечить специальные условия (например, довольно высокую температуру или свет), чтобы проведение химической реакции стало возможным.
Реакции замещения
К реакциям этого типа относятся галогенирование и нитрование. Галогенирование (взаимодействие с Cl2 или Br2) происходит при нагревании или же под воздействием света. Во время реакции, протекающей последовательно, образуются галогеналканы.
Для примера можно записать реакцию хлорирования этана.
Бромирование будет проходить аналогичным образом.
Нитрование - это реакция со слабым (10%) раствором HNO3 или с оксидом азота (IV) NO2. Условия для проведения реакций - температура 140 °C и давление.
C3H8 + HNO3 = C3H7NO2 + H2O.
В результате образуются два продукта - вода и аминокислота.
Реакции разложения
При проведении реакций разложения всегда требуется обеспечивать высокую температуру. Это необходимо для разрыва связей между атомами углерода и водорода .
Так, при проведении крекинга потребуется температура в интервале от 700 до 1000 °C . Во время реакции разрушаются -С-С- связи, образуется новый алкан и алкен:
C8H18 = C4H10 + C4H8
Исключение - крекинг метана и этана. В результате этих реакций выделяется водород и образуется алкин ацетилен. Обязательным условием является нагревание до 1500 °C.
C2H4 = C2H2 + H2
Если превысить температуру в 1000 °C, можно добиться пиролиза с полным разрывом связей в соединении:
Во время пиролиза пропила был получен углерод C, а также выделился водород H2.
Реакции дегидрирования
Дегидрирование (отщепление водорода) происходит по-разному для различных алканов. Условия проведения реакции - температура в пределах от 400 до 600 °C, а также присутствие катализатора, в роли которого могут выступать никель или платина.
Из соединения, в углеродном скелете которого 2 или 3 атома C, образуется алкен:
C2H6 = C2H4 + H2.
Если в цепи молекулы 4-5 атомов углерода, то после дегидрирования получится алкадиен и водород.
C5H12 = C4H8 + 2H2.
Начиная с гексана, во время реакции образуется бензол или производные от него вещества.
C6H14 = C6H6 + 4H2
Следует также упомянуть реакцию конверсии, проводящуюся для метана при температуре 800 °C и в присутствии никеля:
CH4 + H2O = CO + 3H2
Для других алканов конверсия нехарактерна.
Окисление и горение
Если алкан, нагретый до температуры не более 200 °C, будет взаимодействовать с кислородом в присутствии катализатора, то в зависимости от прочих условий проведения реакции будут различаться получаемые продукты: это могут быть представители классов альдегидов, карбоновых кислот, спиртов или кетонов.
В случае полного окисления алкан сгорает до конечных продуктов - воды и CO2:
C9H20 + 14O2 = 9CO2 + 10H2O
Если во время окисления количество кислорода оказалось недостаточным, конечным продуктом вместо углекислого газа станет уголь или CO.
Проведение изомеризации
Если обеспечить температуру около 100-200 градусов, для неразветвленных алканов становится возможна реакция перегруппировки. Второе обязательное условие для проведения изомеризации - присутствие катализатора AlCl3. В таком случае происходит изменение структуры молекул вещества и образуется его изомер.
 Значительную долю алканов получают, выделяя их из природного сырья
. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
Значительную долю алканов получают, выделяя их из природного сырья
. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
А также следует вспомнить о химических свойствах алкенов. В 10 классе одним из первых лабораторных способов, изучаемых на уроках химии, является гидрирование непредельных углеводородов.
C3H6 + H2 = C3H8
Например, в результате присоединения водорода к пропилену получается единственный продукт - пропан.
При помощи реакции Вюрца из моногалогеналканов получают алканы, в структурной цепи которых число углеродных атомов удвоено:
2CH4H9Br + 2Na = C8H18 + 2NaBr.
Ещё один способ получения - взаимодействие соли карбоновой кислоты со щёлочью при нагревании:
C2H5COONa + NaOH = Na2CO3 + C2H6.
Кроме того, метан иногда получают в электрической дуге (C + 2H2 = CH4) или при взаимодействии карбида алюминия с водой:
Al4C3 + 12H2O = 3CH4 + 4Al (OH)3.
Алканы широко применяются в промышленности в качестве низкого по стоимости топлива. А также их используют как сырьё для синтеза других органических веществ. С этой целью обычно применяют метан, необходимый для и синтез-газа. Некоторые другие предельные углеводороды используют, чтобы получать синтетические жиры, а также как основу для смазочных материалов.
Для наилучшего понимания темы «Алканы» создан не один видеоурок, в котором подробно рассмотрены такие темы, как структура вещества, изомеры и номенклатура, а также показаны механизмы химических реакций.
.
Алканы - название предельных углеводородов по международной номенклатуре. Парафины - исторически сохранившееся название предельных углеводородов.
В молекулах этих соединений все валентные связи углерода и водорода полностью насыщены. Вот почему эти углеводороды не способны к реакциям присоединения. В этой связи данному классу углеводородов можно дать такое определение:
Углеводороды с общей формулой C n H 2n+2 , которые не присоединяют водород и другие элементы, называются предельными углеводородами или алканами (парафинами)
.
Простейшим представителем предельных углеводородов является метан.
Строение молекулы метана.
Молекулярная формула метана CH 4 .
Так как в гибридизации участвуют s
- электрон и три p
- электрона, то такой ее вид называется sp 3 - гибридизацией.
Валентный угол: 109
градусов.
Гомологи метана.
Существует много углеводородов, сходных с метаном, т.е. гомологов метана (греч. "гомолог" - сходный). В из молекулах имеются два, три, четыре и более атомов углерода. Каждый последующий углеводород отличается от предыдущего группой атомов CH 2 . Например, если мысленно к молекуле метана CH 4 добавить группу CH 2 (группу CH 2 называют гомологической разностью), то получается следующий углеводород ряда метана - этан C 2 H 6 и т.д.
Гомологический рад метана.
CH 4 - Метан
C 2 H 6 - Этан
C 3 H 8 - Пропан
C 4 H 10 - Бутан
C 5 H 12 - Пентан
C 6 H 14 - Гексан
C 7 H 16 - Гептан
C 9 H 20 - Нонан
Изомерия и номенклатура.
Для составления названий предельных углеводородов с разветвленной цепью принимают, что во всех молекулах атомы водорода замещены различными радикалами. Для определения названий данного углеводорода придерживаются определенного порядка:
- Выбирают в формуле наиболее длинную углеродную цепь и символы атомов углерода нумеруют, начиная с того конца цепи, к которому ближе разветвление.
- Называют радикалы (начиная с простейшего) и при помощи цифр указывают место у нумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых радикала, тогда номер повторяют дважды. Число одинаковых радикалов указывают при помощи чисел на греческом языке ("ди" - два, "три" - три, "тетра" - четыре и т.д.)
- Полное название данному углеводороду дают по числу атомов углерода в нумерованной цепи.
Нахождение в природе.
Простейший представитель предельных углеводородов - метан - образуется в природе в результате разложения остатков растительных и животных организмов без доступа воздуха. Этим объясняется появление пузырьков газа в заболоченных водоемах. Иногда метан выделяется из каменноугольных пластов и накапливается в шахтах. Метан составляет основную массу природного газа (80 -97% ). Он содержится и в газах, выделяющихся при добыче нефти. В состав природного газа и нефтяных газов входят также этан C 2 H 6 , пропан C 3 H 8 , бутан C 4 H 10 и некоторые другие. Газообразные, жидкие и твердые предельные углеводороды содержаться в нефти.
Физические свойства.
Метан - газ без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Этан, пропан, бутан при нормальных условиях - газы, от пентана до пентадекана - жидкости, а следующие гомологи - твердые вещества.
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
Определение 1
Алканами называют такие углеводороды, атомы углерода, в молекулах которых соединены между собой простыми (одинарными) $\sigma $- связями. Все остальные единицы валентности атомов углерода в этих соединениях заняты (насыщенны) атомами водорода.
Атомы углерода в молекулах насыщенных углеводородов находятся в первом валентном состоянии, то есть в состоянии $sp3$-гибридизации. Такие насыщенные углеводороды еще называют парафинами .
Парафинами эти органические соединения называют потому, что долгое время их считали малореакцийноспособными (от лат. parum - мало и affinis - имеет сродство).
Старое название насыщенных углеводородов - алифатические или жирные, углеводороды (от лат. alifatic - жирный). Это название происходит от названия первых изученных соединений, которые когда-то относили к этим веществам, - жиров.
Насыщенные углеводороды образуют ряд соединений с общей формулой $C_nH_{(2_n+2)}$ $(n - 1, 2, 3, 4, ...)$. Простой соединением этого ряда является метан $CH_4$. Поэтому ряд этих соединений называют еще рядом метановых углеводородов.
Гомологические ряды
Соединения ряда метана имеют подобные строение и свойства. Такой ряд соединений, представители которого имеют близкие химические свойства и характеризуются закономерной сменой физических свойств, имеют однотипную структуру и отличаются друг от друга на одну или несколько $-CH_2$-групп, называют гомологичным рядом (от греч. «гомос » - сходство). Каждый последующий углеводород данного ряда отличается от предыдущего на группу $-CH_2$. Эта группа называется гомологичной разницей, а отдельные члены этого ряда - гомологами.
Происхождение названий алканов
Названия первых четырех насыщенных углеводородов (метан, этан, пропан, бутан) возникли случайно. Например, корень слова «этан» произошел от латинского слова ether - эфиы, так как остаток этана $-C_2H_5$ входит в состав медицинского эфира. Начиная с $C_5H_{12}$, названия алканов образованы от греческих или латинских числительных, которые указывают количество углеродных атомов в молекуле данного насыщенного углеводорода с добавлением к этим названиям суффикса -ан. Так, углеводород $C_5H_{12}$ называется пентан (от греч. «пента » - пять), $C_6H_{14}$ - гексан (от греч. «гекса » - шесть), $C_7H_{10}$ - гептан (от греч. «гепта » - семь) и т. д.
Правила систематической номенклатуры
Для названия органических веществ комиссией Международного союза теоретической и прикладной химии (IUPAC) были разработаны правила систематической (научной) номенклатуры. Согласно этим правилам, названия углеводородам дают таким образом:
В молекуле углеводорода выбирают основную - длинную и сложную (которая имеет наибольшее число ответвлений) - углеродную цепь.
Нумеруют атомы углерода основной цепи. Нумерацию осуществляют последовательно с того конца цепи, который дает радикалу наименьший номер. Если существует несколько алкильных радикалов, то сравнивают величину цифр двух возможных последовательных нумерации. И нумерация, в которой первой встречается меньше цифра, чем во второй последовательной нумерации, считается «меньше» и используется для составления названия углеводорода.
Нумерация справа налево будет «меньше», чем нумерация слева направо.
Называют углеводородные радикалы, которые образуют боковые цепи. Перед названием каждого радикала ставят цифру, которая указывает номер углеродного атома главной цепи, у которого с находится данный радикал. Цифру от названия отделяют дефисом. Названия алкильных радикалов перечисляют в алфавитном порядке. Если углеводород имеет в своем составе несколько одинаковых радикалов, то записывают в порядке возрастания номера углеродных атомов, у которых стоят эти радикалы. Цифры отделяют друг от друга запятыми. После цифр записывают префиксы: ди- (если одинаковых радикалов два), три- (когда одинаковых радикалов три), тетра-, пента- и т. д. (если одинаковых радикалов соответственно четыре, пять и т. д.). Префиксы указывают, сколько одинаковых радикалов имеет данный углеводород. После префикса ставят название радикала. В том случае, если два одинаковых радикалы находятся у одного углеродного атома, номер этого атома углерода ставится в названии дважды.
Называют углеводород основной пронумерованной углеродной цепи, помня при этом, что названия всех насыщенных углеводородов имеют суффикс -ан.
Приведенный ниже пример поможет уяснить эти правила:
Рисунок 1.
Алкильные радикалы боковых цепей
Иногда алкильные радикалы боковых цепей разветвленные. В этом случае их называют так, как соответствующие насыщенные углеводороды, только вместо суффикса -ан принимают суффикс -ил.
Углеродную цепь разветвленного радикала нумеруют. Атом углерода этого радикала, соединенный с основным цепью, получает номер $1$. Для удобства углеродную цепь разветвленного радикала нумеруют цифрами со штрихами и полное название такого радикала берут в скобки:
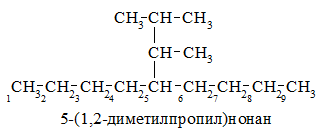
Рисунок 2.
Рациональная номенклатура
Кроме систематической для названия насыщенных углеводородов используют еще рациональную номенклатуру. По этой номенклатуре насыщенные углеводороды рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на радикалы. Название насыщенного углеводорода по рациональной номенклатуре образуют таким образом: называют по степени сложности все радикалы, которые находятся у атома углерода с наибольшим количеством заместителей (отмечая их количество, если они одинаковые), а затем добавляют основу названия углеводорода по этой номенклатуре - слово «метан». К примеру:

Рисунок 3.
Рациональную номенклатуру пользуются для названия сравнительно простых углеводородов. Эта номенклатура не так усовершенствована и гораздо менее удобна в пользовании по сравнению с систематической номенклатурой. По рациональной номенклатуре одно и то же вещество может иметь разные названия, что очень неудобно. Кроме того, по данной номенклатуре можно назвать далеко не все насыщенные углеводороды.
Дата: ____________
11-11
Алканы. Гомологический ряд алканов. Номенклатура и изомерия алканов
ТЕМА
ЦЕЛЬ
Дать учащимся понятие о предельных углеводородах, их химическом, пространственном и электронном строении. Ознакомить с понятием гомологии, правилами названия веществ и составления формул по современной номенклатуре. Продолжить формирование мировоззренческих понятий: о познаваемости природы, причинно-следственной зависимости между составом, строением, свойствами и применением предельных углеводородов.
СОДЕРЖАНИЕ
Гомологический ряд алканов и их строение
ТЕРМИНЫ
Алкан, гомологи, изомеры
ХИМ ЭКСПЕРИМЕНТ
ОБОРУДОВАНИЕ
Интерактивная доска
ДОМ ЗАДАНИЕ
ПЛАН УРОКА.
Опрос домашнего задания. Актуализация знаний
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями (-) и имеют общую формулу:
C n H 2n+2
Что такое гомологи? (учащиеся отвечают на данный вопрос)
Гомологический ряд алканов
Алканы, имея общую формулу С n H 2 n +2 , представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (- CH 2 -). Такая последовательность соединений называется гомологическим рядом (от греч. homolog – сходный), отдельные члены этого ряда – гомологами , а группа атомов, на которую различаются соседние гомологи, – гомологической разностью .
Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами водорода. Другой вариант – добавление в цепь группы -СН 2 -:
CH 4 или Н- СН 2 -Н – первый член гомологического ряда – метан
(содержит 1 атом углерода);
CH 3 - CH 3 или Н- СН 2 -СН 2 -Н – 2-й гомолог – этан (2 атома С);
CH 3 - CH 2 - CH 3 или Н- СН 2 -СН 2 -СН 2 -Н – 3-й гомолог – пропан (3 атома С);
CH 3 - CH 2 - CH 2 - CH 3 или Н- СН 2 -СН 2 -СН 2 - СН 2 - Н – бутан (4 атома С)
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса –ан : пентан С 5 Н 12 , гексан С 6 Н 14 , гептан С 7 Н 16 , октан С 8 Н 18 , нонан С 9 Н 20 , декан С 10 Н 22 и т.д.
Виды изомерии для алканов:
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами .
Различия в порядке соединения атомов в молекулах (т. е. в химическом строении) приводят к структурной изомерии . Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т. е. начиная с бутана С 4 Н 10 . Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия) . В этом случае использование структурных формул недостаточно и следует применять модели молекул или пространственные (стереохимические) формулы. Алканы, начиная с этана С 2 Н 6 , существуют в различных пространственных формах, обусловленных внутримолекулярным вращением по s-связям С–С, и проявляют так называемую поворотную изомерию .
Кроме того, при наличии в молекуле 7-ми и более углеродных атомов, возможен еще один вид пространственной изомерии, когда два изомера относятся друг к другу как предмет и его зеркальное изображение (подобно тому, как левая рука относится к правой).
Такие различия в строении молекул называют зеркальной или оптической изомерией.
Алгоритм.
1. Выбор главной цепи:

2. Нумерация атомов главной цепи:

3. Формирование названия:

2 - метилбутан
Строение алканов.
Атом углерода во всех органических веществах находится в "возбуждённом" состоянии, т. е. Имеет на внешнем уровне четыре неспаренных электрона.
Каждое электронное облако обладает запасом энергии: s- облако имеет менший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается наформе и направленности облаков, происходит перестройка (пространственная) электронных облаков.
В результате sp3 - гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109° 28", поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними.
Все органические вещества построены в основном за счёт ковалентных связей. Углерод - углеродные и углерод - водородные связи относятся к сигма - связям - это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма - связей, поскольку эта связь имеет осевую симметрию.
Для закрепления материала ответить на вопросы в конце параграфа, а также выполнить задания по задачнику
Домашнее задание: §3.1 пересказ, №3,4,6,8 стр. 67
ОПРЕДЕЛЕНИЕ
Алканы – предельные (алифатические) углеводороды, состав которых выражается формулой C n H 2 n +2 .
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH 2 , а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C 1 H3 – C 2 H 2 – C 1 H 3 (1 – первичные, 2- вторичные атомы углерода)
CH 3 –C 3 H(CH 3) – CH 3 (3- третичный атом углерода)
CH 3 – C 4 (CH 3) 3 – CH 3 (4- четвертичный атом углерода)
Для алканов характерна структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 (пентан)
CH 3 –CH(CH 3)-CH 2 -CH 3 (2-метилбутан)
CH 3 -C(CH 3) 2 -CH 3 (2,2 – диметилпропан)
Для алканов, начиная с гептана, характерна оптическая изомерия.
Атомы углерода в предельных углеводородах находятся в sp 3 –гибридизации. Углы между связями в молекулах алканов 109,5.
Химические свойства алканов
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Реакции радикального замещения имеют цепной характер. Основные стадии: зарождение (инициирование) цепи (1) – происходит под действием УФ-излучения и приводит к образованию свободных радикалов, рост цепи (2) – происходит за счет отрыва атома водорода от молекулы алкана; обрыв цепи (3) – происходит при столкновении двух одинаковых или разных радикалов.
X:X → 2X . (1)
R:H + X . → HX + R . (2)
R . + X:X → R:X + X . (2)
R . + R . → R:R (3)
R . + X . → R:X (3)
X . + X . → X:X (3)
Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
CH 3 Cl +Cl 2 = CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 +Cl 2 = CHCl 3 + HCl (трихлорметан)
CHCl 3 +Cl 2 = CCl 4 + HCl (тетрахлорметан)
Нитрование (реакция Коновалова) . При действии разбавленной азотной кислоты на алканы при 140С и небольшом давлении протекает радикальная реакция:
CH 3 -CH 3 +HNO 3 = CH 3 -CH 2 -NO 2 (нитроэтан) + H 2 O
Сульфохлорирование и сульфоокисление. Прямое сульфирование алканов протекает с трудом и чаще всего сопровождается окислением, в результате чего образуются алкансульфонилхлориды:
R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl
Реакция сульфоокисления протекает аналогично, только в этом случае образуются алкансульфоновые кислоты:
R-H + SO 2 + ½ O 2 → R-SO 3 H
Крекинг – радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
С 8 H 18 = C 4 H 10 (бутан)+ C 3 H 8 (пропан)
2CH 4 = C 2 H 2 (ацетилен) + 3H 2
Окисление . При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
C n H 2 n +2 + (3n+1)/2 O 2 = nCO 2 + (n+1)H 2 O
Физические свойства алканов
При обычных условиях С 1 -С 4 – газы, С 5 -С 17 – жидкости, начиная с С 18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН 4 (болотный, рудничий газ) – газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде. Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С 3 Н 8 и бутан С 4 Н 10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
nC + (n+1)H 2 = C n H 2 n +2 (1)
nCO + (2n+1)H 2 = C n H 2 n +2 + H 2 O (2)
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R 1 -C≡C-R 2 (алкин) → R 1 -CH = CH-R 2 (алкен) → R 1 -CH 2 – CH 2 -R 2 (алкан) (1)
R-Cl + Mg → R-Mg-Cl + H 2 O → R-H (алкан) + Mg(OH)Cl (2)
CH 3 COONa↔ CH 3 COO — + Na +
2CH 3 COO — → 2CO 2 + C 2 H 6 (этан) (3)
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 (4)
R 1 -Cl +2Na +Cl-R 2 →2NaCl + R 1 -R 2 (5)
Примеры решения задач
ПРИМЕР 1
| Задание | Определите массу хлора, необходимого для хлорирования по первой стадии 11,2 л метана. |
| Решение |
Запишем уравнение реакции первой стадии хлорирования метана (т.е. в реакции галогенирования происходит замещения всего одного атома водорода, в результате чего образуется монохлорпроизводное):
CH 4 + Cl 2 = CH 3 Cl + HCl (хлорметан) Найдем количество вещества метана: v(CH 4) = V(CH 4)/V m v(CH 4) = 11,2/22,4 = 0,5 моль По уравнению реакции количество моль хлора и количество моль метана равны 1 моль, следовательно, практическое количество моль хлора и метана также будет одинаковым и будет равно: v(Cl 2) = v(CH 4) = 0,5 моль Зная количество вещества хлора можно найти его массу (что и поставлено в вопросе задачи). Масса хлора рассчитывается как произведение количества вещества хлора на его молярную массу (молекулярная масса 1 моль хлора; молекулярная масса рассчитывается с помощью таблицы химических элементов Д.И. Менделеева). Масса хлора будет равна: m(Cl 2) = v(Cl 2)×M(Cl 2) m(Cl 2) = 0,5×71 = 35,5 г |
| Ответ | Масса хлора равна 35,5 г |